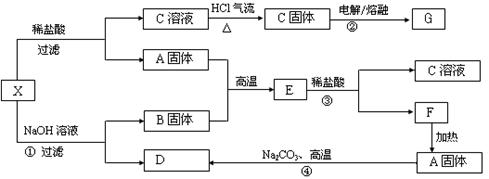
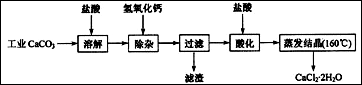
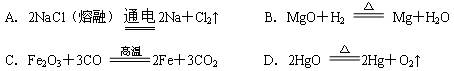题目内容
将一定质量的锌粉与100 mL 18.5 mol·L-1的浓H2SO4混合,充分反应后锌完全溶解,生成了标准状况下的混合气体33.6 L(设浓H2SO4的还原产物只有SO2,稀硫酸只生成H2),将反应后的溶液稀释成1L时,溶液pH=1,参加反应的锌为 ( )
| A.0.9 mol | B.1.2 mol | C.1.5 mol | D.1.8 mol |
C
由反应式:Zn+2H2SO4(浓)====ZnSO4+SO2↑+2H2O,Zn+H2SO4====ZnSO4+H2↑,不论生成SO2还是H2,Zn的物质的量都与气体的物质的量相等。
故n(Zn)=n(气)=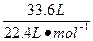 ="1.5" mol。
="1.5" mol。
故n(Zn)=n(气)=
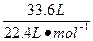 ="1.5" mol。
="1.5" mol。
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 、Cl-
、Cl- 、MnO-4
、MnO-4