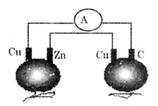
题目内容
将0.2molAgNO3、0.4molCu(NO3)2、0.6molKCl溶于水,配成100mL溶液,用惰性电极电解一段时间后,若在一极析出0.3molCu,此时在另一极上产生的气体体积(标准状况)为( )
| A.4.48L | B.5.6L | C.6.72L | D.7.84L |
C
由Ag++Cl-=AgCl↓可知,0.2molAg+和0.2molCl-沉淀;
在阴极上有0.3molCu2+放电: Cu2++2e-=Cu,转移电子为0.6mol;
在阳极上先有0.6mol-0.2mol=0.4mol的Cl-放电:2Cl--2e-=Cl2↑,生成氯气0.2mol;然后为保证电子的得失守恒,又有0.2mol的OH-放电:4OH--4e-=2H2O+O2↑,生成0.05mol氧气,共生成0.25mol气体,体积为6.72升
答案为C
在阴极上有0.3molCu2+放电: Cu2++2e-=Cu,转移电子为0.6mol;
在阳极上先有0.6mol-0.2mol=0.4mol的Cl-放电:2Cl--2e-=Cl2↑,生成氯气0.2mol;然后为保证电子的得失守恒,又有0.2mol的OH-放电:4OH--4e-=2H2O+O2↑,生成0.05mol氧气,共生成0.25mol气体,体积为6.72升
答案为C

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 ,下列说法正确的是
,下列说法正确的是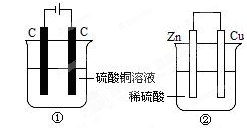
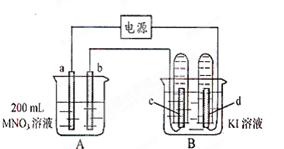

 。电解进行一段时
。电解进行一段时 也收集到了气体,此时c极上的电极反应式为: 。
也收集到了气体,此时c极上的电极反应式为: 。 溶液的物质的量浓度为 mol·L-1。
溶液的物质的量浓度为 mol·L-1。