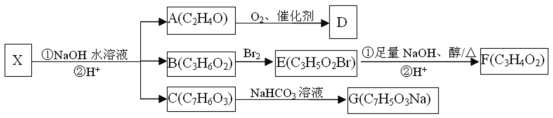
题目内容
【题目】铝是一种应用广泛的金属,工业上用![]() 和冰晶石(
和冰晶石(![]() )混合熔融电解制得。
)混合熔融电解制得。
①铝土矿的主要成分是![]() 和
和![]() 等。从铝土矿中提炼
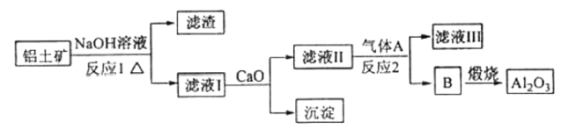
等。从铝土矿中提炼![]() 的流程如下:
的流程如下:
②以萤石(![]() )和纯碱为原料制备冰晶石的流程如下:
)和纯碱为原料制备冰晶石的流程如下:

请回答下列问题:
(1)写出反应1的化学方程式____________。
(2)滤液1中加入![]() 生成的沉淀是____________,反应2的离子方程式为____________(气体
生成的沉淀是____________,反应2的离子方程式为____________(气体![]() 过量)。
过量)。
(3)![]() 可作为建筑材料,化合物
可作为建筑材料,化合物![]() 是浓硫酸,请写出由
是浓硫酸,请写出由![]() 制备冰晶石的化学方程式____________。
制备冰晶石的化学方程式____________。
(4)电解氧化铝制铝时,以石墨为电极,请写出阳极的电极反应式____________。
【答案】![]() 、
、![]()
![]()
![]()
![]()
![]()
【解析】
①由工艺流程可知:铝土矿投入氢氧化钠,二氧化硅与氢氧化钠反应生成硅酸钠和水,氧化铝与氢氧化钠反应生成偏铝酸钠和水,加入CaO,生成氢氧化钙,氢氧化钙与硅酸钠反应生成硅酸钙沉淀,滤液中通入二氧化碳反应生成氢氧化铝沉淀,氢氧化铝分解生成氧化铝;
②由工艺流程可知,气体D是HF,根据元素守恒,可知HF与碳酸钠、氢氧化铝反应生成冰晶石,同时生成二氧化碳、水;电解熔融氧化铝生成铝和氧气,阳极发生氧化反应,据此分析解答。
(1)铝土矿的主要成分是![]() 和
和![]() 等。二氧化硅与氢氧化钠反应生成硅酸钠与水,反应方程式为:2NaOH+SiO2=Na2SiO3+H2O,氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应方程式为:2NaOH+Al2O3=2NaAlO2+H2O,故答案为:2NaOH+SiO2=Na2SiO3+H2O;2NaOH+Al2O3=2NaAlO2+H2O;
等。二氧化硅与氢氧化钠反应生成硅酸钠与水,反应方程式为:2NaOH+SiO2=Na2SiO3+H2O,氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应方程式为:2NaOH+Al2O3=2NaAlO2+H2O,故答案为:2NaOH+SiO2=Na2SiO3+H2O;2NaOH+Al2O3=2NaAlO2+H2O;
(2)滤液Ⅰ中含有硅酸钠、偏铝酸钠,向溶液中加入![]() ,与水反应生成氢氧化钙,氢氧化钙能够与硅酸钠反应生成硅酸钙沉淀;滤液2中含有偏铝酸钠,根据流程图可知,B为氢氧化铝,因此气体A为二氧化碳,过量的二氧化碳与偏铝酸钠反应生成氢氧化铝与碳酸氢钠,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:CaSiO3;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
,与水反应生成氢氧化钙,氢氧化钙能够与硅酸钠反应生成硅酸钙沉淀;滤液2中含有偏铝酸钠,根据流程图可知,B为氢氧化铝,因此气体A为二氧化碳,过量的二氧化碳与偏铝酸钠反应生成氢氧化铝与碳酸氢钠,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:CaSiO3;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)由工艺流程可知,浓硫酸与![]() 反应生成硫酸钙和HF,硫酸钙是石膏的主要成分,是常用的一种建筑材料。根据元素守恒,可知HF与碳酸钠、氢氧化铝反应生成冰晶石,同时生成二氧化碳、水,反应方程式为:12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O,故答案为:12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O;
反应生成硫酸钙和HF,硫酸钙是石膏的主要成分,是常用的一种建筑材料。根据元素守恒,可知HF与碳酸钠、氢氧化铝反应生成冰晶石,同时生成二氧化碳、水,反应方程式为:12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O,故答案为:12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O;
(4)电解熔融的氧化铝得到铝和氧气,阳极上氧离子失去电子发生氧化反应,电极反应式:2O2--4e-=O2↑,故答案为:2O2--4e-=O2↑。

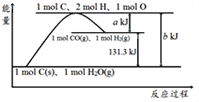
【题目】在800℃时,2L密闭容器内发生反应:2NO(g)+O2(g)2NO2(g),反应体系中,一氧化氮的物质的量随时间的变化如表所示:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)如图表示NO2的物质的量浓度变化的曲线是________。
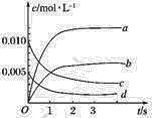
(2)用O2表示从0~2 s内该反应的平均速率v=__________。
(3)能说明该反应已达到平衡状态的是________。
A.v(NO2)=2v(O2)
B.容器内压强保持不变
C.容器内气体质量不变
D.容器内密度保持不变