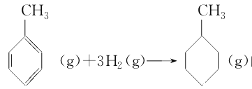题目内容
【题目】氧化锌吸收法常用作脱去冶金工业排放烟气中的SO2,其主要步骤如下:配制ZnO悬浊液(含少量MgO、CaO),在吸收塔中封闭循环脱硫,发生的主要反应为ZnO(s)+SO2(g)=ZnSO3(s),
试回答下列问题:
(1)生成的ZnSO3可热分解处理,其目的是:①生成的高浓度SO2可以用来制备硫酸;②___________;
(2)已知:纯ZnO的悬浮液pH约为6.8.用氧化锌吸收法脱去烟气中SO2的过程中,测得pH随时间t的变化如图1所示。已知被吸收的SO2为c(SO2)吸,溶液中SO32-、HSO3-、H2SO3所占物质的量之比与pH的关系如图2所示。
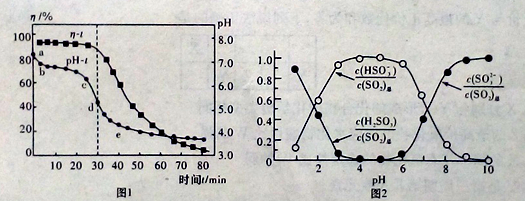
①充分吸收烟气后的混合体系硫元素的主要存在形式是__________________;
②结合图1与图2分析,cd段发生的主要反应是__________________
③为提高SO2的吸收速率η,可采取的措施为 (填字母)。
A.调节悬浊液中ZnO的量
B.适当提高单位时间内烟气的循环次数
C.调节溶液的pH至6.0以下
(4)如用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)
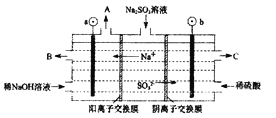
b极的电极反应式为____________________。
【答案】(1)ZnSO3受热的分解生成ZnO可以循环利用
(2)①HSO3-(2分)②ZnSO3+SO2+H2O=Zn(HSO3)2(2分)
③AB(2分)(3)SO32—2e-+H2O=SO42-+2H+(2分)
【解析】
试题分析:(1)ZnO悬浊液吸收SO2,ZnSO3受热分解生成ZnO,则ZnSO3受热分解生成ZnO可以循环利用;
(2)①由图2可知,充分吸收烟气后溶液的pH大约为6,由图3判断硫元素的主要存在形式为HSO3-;
②cd段发生的主要反应是生成了HSO3-,则cd段发生的主要反应是ZnSO3与二氧化硫反应生成Zn(HSO3)2,其反应方程为ZnSO3+SO2+H2O=Zn(HSO3)2;
③增大另一种反应物的量,可以提高SO2的吸收效率η,所以增大悬浊液中ZnO的量,多次循环吸收均可以提高SO2的吸收效率η;pH越小SO2的吸收效率η越小;答案选AB;
(4)SO32-失去电子被氧化成SO42-,电极反应式为:SO32--2e-+H2O=SO42-+2H+。

 阅读快车系列答案
阅读快车系列答案