题目内容
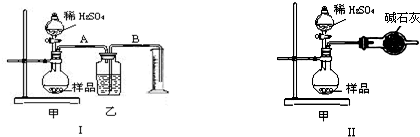
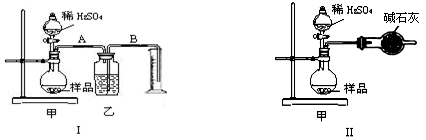
某校化学兴趣小组的同学利用漂白粉与稀硫酸在加热条件下反应制取Cl2,其反应的化学方程式为:Ca(ClO)2+CaCl2+2H2SO4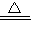 2CaSO4+2Cl2↑+2H2O.以下是制取Cl2并验证其部分性质的实验装置.
2CaSO4+2Cl2↑+2H2O.以下是制取Cl2并验证其部分性质的实验装置.
试回答下列问题:
(1)请在上图(右上装置中)选择满足实线框图I的气体发生装置:______(填代号);
(2)实验装置Ⅲ的作用是______;
(3)一段时间后,装置Ⅲ的溶液仍呈强碱性,其中肯定存在Cl-、OH-和SO42-,请设计实验探究该吸收液中可能存在的其它阴离子(不考虑空气中CO2的影响).
①提出合理假设:假设1:只存在SO32-; 假设2:只存在ClO-; 假设3:______
②设计实验方案进行实验,请写出实验步骤以及预期现象和结论.实验试剂:3mol?L-1 H2SO4、1mol?L-1 NaOH、0.01mol?L-1 KMnO4、淀粉KI溶液、紫色石蕊试液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol?L-1 H2SO4至溶液显酸性,然后将所得溶液分置于A、B试管中. | / |
| 步骤2:______ | ______ |
| 步骤3:______ | ______ |
【答案】分析:(1)根据反应物的状态及反应条件选择相应的装置;
(2)二氧化硫和氢氧化钠反应生成亚硫酸钠,氯气有毒,氯气和亚硫酸钠、氢氧化钠反应转化为无毒物质,Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O据此分析;
(3)①根据反应原理:Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O,可假设1、溶液中可能存在只存在SO32-,假设2、只存在ClO-,假设3、既不存在SO32-也不存在ClO-;
②根据所限制实验试剂和SO32-、ClO-的性质,先加入硫酸至酸性,若存在SO32-、ClO-,分别生成了H2SO3和HClO;因为HClO具有酸性和漂白性,选择紫色石蕊试液,证明有ClO-的存在;H2SO3具有还原性,选择具有强氧化性的高锰酸钾溶液,证明SO32-的存在.
解答:解:(1)反应物是固体和液体,反应条件是加热,所以应选择固、液混合加热型装置,故答案为:b;
(2)二氧化硫和氢氧化钠反应生成亚硫酸钠,氯气有毒,所以不能直接排空,氯气和亚硫酸钠、氢氧化钠反应转化为无毒物质,Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O,所以该装置的作用是吸收多余氯气,防止污染大气.
故答案为:吸收多余氯气,防止污染大气;
(3)①根据反应原理:Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O,可提出以下假设:
假设1、溶液中可能存在只存在SO32-,
假设2、溶液中只存在ClO-,
假设3、既不存在SO32-也不存在ClO-.
②因为吸收液呈碱性,先取少量吸收液于试管中,滴加3moL-L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中先加入硫酸的试管,若存在SO32-、ClO-,分别生成了H2SO3和HClO;
在A试管中滴加0.01mol?L-1KMnO4溶液,若紫红色褪去,证明有SO32-,否则无.
在B试管中滴加紫色石蕊试液,若先变红后褪色,证明有ClO-,否则无;
故答案为:既不存在SO32-,也不存在ClO-;
点评:本题属于实验探究题,要根据实验原理提出假设,再结合物质的性质加以验证,如利用次氯酸的酸性和漂白性验证是否含有次氯酸根离子,利用亚硫酸的还原性验证是否含有亚硫酸根离子.
(2)二氧化硫和氢氧化钠反应生成亚硫酸钠,氯气有毒,氯气和亚硫酸钠、氢氧化钠反应转化为无毒物质,Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O据此分析;
(3)①根据反应原理:Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O,可假设1、溶液中可能存在只存在SO32-,假设2、只存在ClO-,假设3、既不存在SO32-也不存在ClO-;
②根据所限制实验试剂和SO32-、ClO-的性质,先加入硫酸至酸性,若存在SO32-、ClO-,分别生成了H2SO3和HClO;因为HClO具有酸性和漂白性,选择紫色石蕊试液,证明有ClO-的存在;H2SO3具有还原性,选择具有强氧化性的高锰酸钾溶液,证明SO32-的存在.
解答:解:(1)反应物是固体和液体,反应条件是加热,所以应选择固、液混合加热型装置,故答案为:b;
(2)二氧化硫和氢氧化钠反应生成亚硫酸钠,氯气有毒,所以不能直接排空,氯气和亚硫酸钠、氢氧化钠反应转化为无毒物质,Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O,所以该装置的作用是吸收多余氯气,防止污染大气.
故答案为:吸收多余氯气,防止污染大气;
(3)①根据反应原理:Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O,可提出以下假设:
假设1、溶液中可能存在只存在SO32-,
假设2、溶液中只存在ClO-,
假设3、既不存在SO32-也不存在ClO-.
②因为吸收液呈碱性,先取少量吸收液于试管中,滴加3moL-L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中先加入硫酸的试管,若存在SO32-、ClO-,分别生成了H2SO3和HClO;
在A试管中滴加0.01mol?L-1KMnO4溶液,若紫红色褪去,证明有SO32-,否则无.
在B试管中滴加紫色石蕊试液,若先变红后褪色,证明有ClO-,否则无;
故答案为:既不存在SO32-,也不存在ClO-;
| 实验步骤 | 预期现象和结论 |
| 步骤2:向A试管中加入O.Olmol?L-1 KMnO4溶液,振荡试管. | (1)若溶液褪色,则假设1成立; (2)若不褪色,则假设2或假设3成立. |
| 步骤3;向B试管中滴加紫色石蕊试液. | (1)若先变红后褪色,则假设2成立;(2)若不褪色,则假设1或假设3成立. |
点评:本题属于实验探究题,要根据实验原理提出假设,再结合物质的性质加以验证,如利用次氯酸的酸性和漂白性验证是否含有次氯酸根离子,利用亚硫酸的还原性验证是否含有亚硫酸根离子.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目