题目内容
【题目】现有如下两个反应:
a.![]() ;
;
b.![]()
(1)反应__________(填字母)不能设计成原电池,原因是____________________。
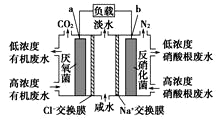
(2)根据上述能设计成原电池的反应,画出简单的原电池实验装置图____________________,并注明电极材料和电解质溶液。写出正极的电极反应式________________________。
【答案】b 反应b不是氧化还原反应 
![]()
【解析】
氧化还原反应有电子转移,只有氧化还原反应才能设计成原电池;原电池的负极发生氧化反应,失电子,正极发生还原反应,得电子。
(1)a是氧化还原反应,b不是,因此b不能设计成原电池;原因是反应b不是氧化还原反应;
(2)原电池结构需要2个电极,需要电解质溶液,构成闭合回路,铜作负极,碳棒可以作正极;电解质溶液为稀硝酸;用导线连接正负极,构成闭合回合,示意图为 ;正极发生还原反应,NO3-得到电子生成NO,电极反应为
;正极发生还原反应,NO3-得到电子生成NO,电极反应为![]() 。
。

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】TiCl4是制备钛及其化合物的重要中间体,可利用下列装置在实验室制备TiCl4(夹持装置略去): TiO2+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO

已知:①PdCl2溶液捕获CO时生成Pd单质;②相关数据如下表:
化合物 | 熔点/℃ | 沸点/℃ | 密度/gcm-3 | 溶解性 |
TiCl4 | -25 | 136 | 1.5 | 能溶于有机溶剂:遇水分解生成难溶于水的物质 |
CCl4 | -23 | 76.8 | 1.6 | 难溶于水 |
回答下列问题:
(1)装置A中连通管的作用是______;装置E中使用冰盐水浴的目的是_____________________。
(2)按照气流由左到右的方向,上述装置合理的连接顺序为____________________ (填仪器接口字母);根据完整的实验装置进行实验,实验步骤如下:_____________; 装入药品;向装置A烧瓶中滴加适量浓盐酸,当观察到_________时,加热装置D中陶瓷管;装置E烧瓶中的液体量不再增加时,停止加热,充分冷却。
(3)装置C的作用为___________________。
(4)装置F中发生反应的化学方程式为________________________。
(5)制得的TiCl4中常含有少量CCl4, 从混合液体中分离出TiCl4的操作名称为_______________。
(6)利用如图所示装置测定产品纯度:称取w g TiCl4产品进行实验,向安全漏斗中加入适量蒸馏水,待四氯化钛充分反应后,将烧瓶和安全漏斗中的液体一并转入锥形瓶中,用氢氧化钠溶液调节至中性,滴加几滴0.1 molL-1的K2CrO4溶液作指示剂,用cmol L-1 AgNO3标准溶液滴定至终点( Ag2CrO4为红棕色沉淀,可指示滴定终点),重复滴定两次,平均消耗标准溶液V mL。
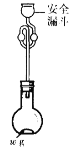
已知:TiCl4 +(2+x)H2O=TiO2xH2O↓+4HCl
①安全漏斗在本实验中的作用除加水外,还有___________。
②根据上述数据计算该产品的纯度为__________。(用含w、c和V的代数式表示)
【题目】根据下列操作、现象,所得结论正确的是![]()
选项 | 操作 | 现象 | 结论 |
A | 向25mL冷水和沸水中分别滴入5滴 | 前者为黄色. 后者为红褐色 | 温度升高, 程度增大 |
B | NaOH的乙醇溶液与溴乙烷共热,产生的气体通入 酸性高锰酸钾溶液中 | 溶液褪色 | 产生的气体为乙烯 |
C | 铜铝合金加入一定量稀硝酸中,有金属剩余,再加稀硫酸 | 剩余金属质量减小 | 铝与稀硫酸反应使 剩余金属质量减小 |
D | 盛有 | 气体变为无色 |
|
A.AB.BC.CD.D