题目内容
【题目】(1)工业合成氨的反应原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH=92.4 kJ/mol。该反应中的H2制取成本较高,工业生产中往往追求H2的转化率。增大H2的平衡转化率的措施有____(填字母代号)。
2NH3(g) ΔH=92.4 kJ/mol。该反应中的H2制取成本较高,工业生产中往往追求H2的转化率。增大H2的平衡转化率的措施有____(填字母代号)。
a.增大压强 b.升高温度 c.增大N2浓度
d.及时移走生成物NH3 e.使用高效催化剂
(2)CrO42-和Cr2O72-在溶液中可相互转化。室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示。
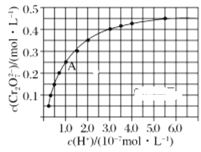
①用离子方程式表示Na2CrO4溶液中发生的转化反应____。
②由图可知,溶液酸性减弱,CrO42-的平衡转化率____(填“增大”、“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为____。
③升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH___0(填“大于”“小于”或“等于”)。
【答案】acd 2CrO42-+2H+![]() H2O+Cr2O72- 减小 1×107 小于
H2O+Cr2O72- 减小 1×107 小于
【解析】
⑴a选项,增大压强,平衡正向移动,转化率增大,故a正确
b选项,升高温度,平衡逆向移动,转化率减小,故b错误
c选项,增大N2浓度,平衡正向移动,转化率增大,故c正确;
d选项,及时移走生成物NH3,平衡正向移动,转化率增大,故d正确;
e选择,使用高效催化剂,平衡不移动,转化率不变,故e错误;
综上所述,答案为acd;
⑵①用离子方程式表示Na2CrO4溶液中发生的转化2CrO42-+2H+![]() H2O+Cr2O72-,故答案为2CrO42-+2H+
H2O+Cr2O72-,故答案为2CrO42-+2H+![]() H2O+Cr2O72-;
H2O+Cr2O72-;
②由图可知,溶液酸性减弱,氢离子浓度降低,平衡逆向移动,CrO42-的平衡转化率减小,根据A点数据,计算出该转化反应的平衡常数为
2CrO42- + 2H+![]() H2O(g) + Cr2O72-
H2O(g) + Cr2O72-
起始量 1.0 mol/L 0 0 0
转化量 0.5mol/L 0.5mol/L 0.25mol/L 0.25mol/L
平衡量 0.5mol/L 1×10-7mol/L 0.25mol/L
![]() ,
,
故答案为减小;1×107;
③升高温度,平衡向吸热反应移动,溶液中CrO42-的平衡转化率减小,说明平衡逆向移动即逆向为吸热反应,正向为放热反应,则该反应的ΔH<0,故答案为小于。