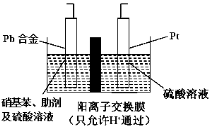
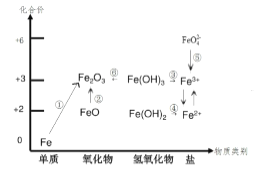
题目内容
【题目】NA 是阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4L 以任意比例混合的 H2 和 CO 中所含原子总数为 2NA
B. 由 32.50g FeCl3 制得的 Fe(OH)3 胶体粒子数为 0.2 NA
C. 常温常压下,Na 与 H2O 反应生成 11.2L H2,反应中转移的电子数为 NA
D. 常温常压下,质量均为 16g 的 O2 和 O3 中,电子数分别是 8NA 和 12NA
【答案】A
【解析】
A.标准状况下,混合气体的物质的量为1mol,H2 和 CO都是双原子分子,故所含原子的物质的量为2mol,即2NA个,故A正确;
B.由于在水溶液中,Fe3+会发生水解,故FeCl3制得的Fe(OH)3 胶体粒子数目一定小于0.2NA,故B错误;
C.常温常压下,不确定气体摩尔体积数值,所以不能计算,故C错误;
D.16g的 O2 和 O3的物质的量分别是0.5mol和![]() mol,1个O2分子含有16个电子,即0.5molO2分子含有8 NA个电子,1个O3分子含有24个电子,即
mol,1个O2分子含有16个电子,即0.5molO2分子含有8 NA个电子,1个O3分子含有24个电子,即![]() molO3分子含有8 NA个电子,故D错误。
molO3分子含有8 NA个电子,故D错误。
故选A。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案【题目】2017年4月26日,海军成立68周年时,我国第一艘国产航母成功下水。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,Ni2+最高能级电子的运动状态有_________种,铬元素在周期表中_____区。
(2)航母甲板涂有一层耐高温的材料聚硅氧烷(结构如下图所示),其中C原子杂化方式为__________杂化。

(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是__________(填元素符号)
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
②根据价层电子对互斥理论,预测ClO3-的空间构型为__________形,写出一个C1O3-的等电子体的化学符号__________________。
③已知高碘酸有两种形式,化学式分别为H5IO6( )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_________HIO4(填“>”“<”或“= ”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_________HIO4(填“>”“<”或“= ”)
(4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、氧化铁、锰、锌等。Zn2+与S2-形成的一种晶体结构如图所示(黑球表示Zn2+,白球表示S2-)。则该晶体中与Zn2+等距且最近的S2-形成的立体图形为______________________。已知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,该晶体中Zn2+和S2-原子之间的最短距离为体对角线的1/4,则该晶体中S2-和Zn2+之间的最短距离为__________________pm。(写出计算式即可)