题目内容
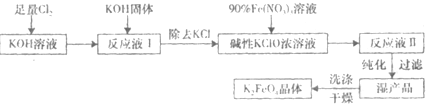
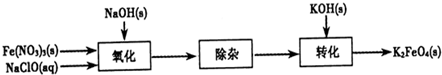
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染.已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示:

(1)在农业生产中,滤液1可用作______.
(2)上述氧化过程中,发生反应的离子方程式是:______,控制反应温度30℃以下的原因是:______.
(3)结晶过程中加入浓KOH溶液的作用是:______.
(4)某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-离子的物质的量之比是1:2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为______.
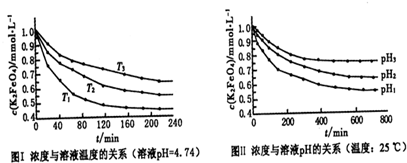
(5)实验测得铁盐溶液的质量分数、反应时间与K2FeO4产率的实验数据分别如下图1、图2所示.为了获取更多的高铁酸钾,铁盐的质量分数应控制在______附近、反应时间应控制在______.

解:(1)硝酸铁和氢氧化钾反应生成了氢氧化铁和硝酸钾,过滤后得到的滤液是硝酸钾溶液,可以用在农业上用作复合肥(或化肥);
故答案为:复合肥(或化肥);
(2)氧化过程中,发生反应的离子方程式是:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O; 由于已知高铁酸盐热稳定性差,温度高了高铁酸钾会分解;
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O; 防止生成的K2FeO4发生分解;
(3)结晶过程中加入浓KOH溶液,增大了K+浓度,有利于K2FeO4晶体的析出;
故答案为:增大K+浓度,促进K2FeO4晶体析出;
(4)假设ClO-与ClO3-离子的物质的量为1mol、2mol,化合价升高:1×1+5×2=11,氯气被还原成了-1价氯离子,被还原的氯元素的物质的量是11mol,故被还原的氯元素与被氧化的氯元素的物质的量之比是11:(1+2)=11:3;
故答案为:11:3
(5)根据图1可知,铁盐的质量分数应控制在30% 左右可以获取更多的高铁酸钾; 根据图2可知,反应时间应控制在60min左右,可以获取更多的高铁酸钾;
故答案为:30% 60min.
分析:(1)滤液1的主要成分是硝酸钾,可以在农业生产中用作化肥;
(2)氢氧化铁料浆和次氯酸钾反应生成了高铁酸钾,反应方程式是:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;已知高铁酸盐热稳定性差,温度不宜过高
(3)加入浓KOH溶液,溶液中钾离子浓度增大,有利于高铁酸钾析出;
(4)设ClO-与ClO3-离子的物质的量为1mol、2mol,根据化合价升降相等,计算出被还原的氯元素和被氧化的氯元素的物质的量之比;
(5)根据图1、图2分析,可以得出最佳反应时间和最佳铁盐的质量分数.
点评:本题考查了高铁酸钾的制取,涉及问题较多,注意分析题中的信息,根据所学化学知识认真完成,本题难度中等.
故答案为:复合肥(或化肥);
(2)氧化过程中,发生反应的离子方程式是:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O; 由于已知高铁酸盐热稳定性差,温度高了高铁酸钾会分解;
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O; 防止生成的K2FeO4发生分解;
(3)结晶过程中加入浓KOH溶液,增大了K+浓度,有利于K2FeO4晶体的析出;
故答案为:增大K+浓度,促进K2FeO4晶体析出;
(4)假设ClO-与ClO3-离子的物质的量为1mol、2mol,化合价升高:1×1+5×2=11,氯气被还原成了-1价氯离子,被还原的氯元素的物质的量是11mol,故被还原的氯元素与被氧化的氯元素的物质的量之比是11:(1+2)=11:3;
故答案为:11:3
(5)根据图1可知,铁盐的质量分数应控制在30% 左右可以获取更多的高铁酸钾; 根据图2可知,反应时间应控制在60min左右,可以获取更多的高铁酸钾;
故答案为:30% 60min.
分析:(1)滤液1的主要成分是硝酸钾,可以在农业生产中用作化肥;
(2)氢氧化铁料浆和次氯酸钾反应生成了高铁酸钾,反应方程式是:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;已知高铁酸盐热稳定性差,温度不宜过高
(3)加入浓KOH溶液,溶液中钾离子浓度增大,有利于高铁酸钾析出;
(4)设ClO-与ClO3-离子的物质的量为1mol、2mol,根据化合价升降相等,计算出被还原的氯元素和被氧化的氯元素的物质的量之比;
(5)根据图1、图2分析,可以得出最佳反应时间和最佳铁盐的质量分数.
点评:本题考查了高铁酸钾的制取,涉及问题较多,注意分析题中的信息,根据所学化学知识认真完成,本题难度中等.

练习册系列答案
相关题目