��Ŀ����
����Ŀ���뼰�仯�����Ӧ�������汻���ӡ�
��l������Ҫ�ĺ������������ʯ����2������Cr��������ʯ��Ϊ��ĸ�̡���̬Crԭ�Ӽ۵����Ų�ͼΪ__________��
��2�����������������Ԫ���������ơ������й��������������ȷ����_____�����ţ���
A��������s������Ԫ�� B���縺�Զ���þ��
C�����ĵ�һ�����ܱ�þС D.�Ȼ����ˮ��ҺpH������7
��3���롢�����嶼���ɽ���ԭ�����ò�����ά�ռ�ѻ����ɣ����ܶѻ���������۵�(155lK)�������۵�(930K)�ߣ�ԭ����_______________________________________________________��
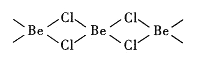
��4���Ȼ�������̬ʱ����BeC12���ӣ�a���Ͷ��۷��ӣ�BeCl2)2(b)����̬ʱ���������ͼ��ʾ����״�ṹ��c����
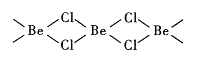
��a����__________�����������������Ǽ����������ӡ�
��b��Beԭ�ӵ��ӻ���ʽ��ͬ��������ԭ�Ӷ���ͬһƽ���ϡ�b �ĽṹʽΪ____________________ �������λ������
��c��Beԭ�ӵ��ӻ���ʽΪ__________��
���Ȼ��뾧�壨c���д��ڵ���������__________�����ţ���
A.��λ�� B. ���� C.���Լ� D���Ǽ��Լ� E�����Ӽ�
��5��BeO������������ͼ��ʾ��
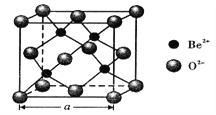
�� BeO�����У�O2-����λ��Ϊ___________��
�� ��BeO������ܶ�Ϊdg/cm3��������
a =___________________________nm ���г�����ʽ���ɣ���
���𰸡� 3d54s1 ABC Beԭ�Ӱ뾶��Alԭ�Ӱ뾶С����������ǿ �Ǽ��� 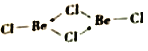 sp3 ABC 4
sp3 ABC 4 ![]()
����������l������24��Ԫ�أ���������Ų����Ϻ��ع���̬Crԭ�Ӽ۵����Ų�ͼΪ3d54s1��
��2����λ�ڵ�2����IIA������s������Ԫ�����������������Ԫ������������������������Ȼ��ﶼ���Է���ˮ��ʹˮ��Һ�����ԣ�pHС��7��������Ľ����Զ���þ�����ǽ����Զ���þǿ�����Ե縺�Զ���þ������þ��3sȫ����3p��3dȫ�գ�����þ�ĵ�һ�����ܸ����ڽ����ƺ������й��������������ȷ����ABC��
��3���롢�����嶼���ɽ���ԭ�����ò�����ά�ռ�ѻ����ɣ����ܶѻ���������۵�(155lK)�������۵�(930K)�ߣ�ԭ����Beԭ�Ӱ뾶��Alԭ�Ӱ뾶С����������ǿ��
��4����BeC12���Ӳ�Be���ӻ�������sp�ӻ���BeC12���ӿռ乹����ֱ���Σ�3ԭ�ӹ����ҷ��ӽṹ�Գƣ����������ڷǼ��Է��ӡ�
����BeCl2)2��Beԭ�ӵ��ӻ���ʽ��ͬ��������ԭ�Ӷ���ͬһƽ������������BeCl2)2����������BeC12����λ���ϳɷ��ӣ���Beԭ�ӵ��ӻ���ʽΪsp2�ӻ�������b �ĽṹʽΪ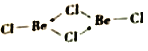 ��
��
�� ��Beԭ�Ӷ��γ�4����������۲���Ӷ���Ϊ4������Beԭ���ӻ���ʽΪsp3��
��Beԭ�Ӷ��γ�4����������۲���Ӷ���Ϊ4������Beԭ���ӻ���ʽΪsp3��
��������ƣ��Ȼ��뾧�壨c���д��ڵ���������.��λ�������������Լ��� ����ѡABC��
��5���� ��ͼ��֪��Be2+����λΪ4������BeO�Ļ�ѧʽ��֪��O2-����λ��Ҳ��4��
�� ��ͼ��֪���þ�������4��������������1mol�˾�����4molBeO��������Ϊ100g�������ΪNAa3����BeO������ܶ�Ϊdg/cm3����![]() dg/cm3����������
dg/cm3����������
a = ![]() cm=
cm=![]()
![]() cm=
cm= ![]() nm��
nm��