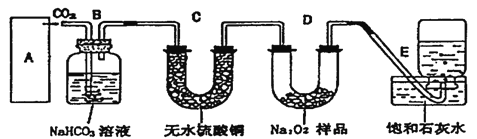
题目内容
【题目】铜的两种氧化物在化工生产中都有着重要的用途。
I.CuO可用于制备Cu2O。
已知:①2Cu2O(s)![]() 4Cu(s)+O2(g) △H1=+338kJ·mol-1;
4Cu(s)+O2(g) △H1=+338kJ·mol-1;
②2CuO(s)![]() 2Cu(s)+O2(g) △H2=+314kJ·mol-1。
2Cu(s)+O2(g) △H2=+314kJ·mol-1。
(1)CuO分解生成2molCu2O的热化学方程式为____________________________________。
(2)温度为T时,向5L恒容密闭容器中加人80g CuO制备Cu2O,5min时恰好达到平衡,测得容器中Cu2O的物质的量为0.4mol。
①该反应的平衡常数K=_____________________。
②5min时缩小容器容积,重新达到平衡时O2的浓度_________(填“增大”“减小”或“不变”)。
③其他条件不变,起始向该容器中充入0.5molCuO,重复实验,达到平衡的时间_____2.5min(填“大于”“小于”或“等于”);达到平衡时Cu2O的物质的量______0.2mol(填“大于”“小于”或“等于”)。
(3)研究表明,在CuO中加入适量碳粉,下列说法中有利于制得纳米级Cu2O的是_____(填选项字母)。
A.碳与氧气反应放热,加快反应速率
B.生成CO气体,使固体颗粒容易分散
C.CO可以将Cu2O还原为铜粉
D.CO作该反应的催化剂
II.CuO可用于冶炼铜(已知:CO的燃烧热△H=-283kJ/mol),一定条件下,将1molCuO和0.5molCO加人2L密闭容器中发生反应,t1时达到平衡,t2后改变容器中的条件,用CO表示的反应速率(v)与时间(t)的关系如图所示(三个阶段改变的条件为温度、压强、浓度中的一个)。
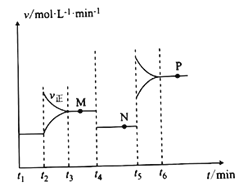
(4)t4时改变的条件为______________________________________________。
(5)M、N、P三点对应状态下,CO的转化率a(M)、a(N)、a(P)的大小关系为_______________。
【答案】4CuO(s) ![]() 2Cu2O(s)+O2(g) △H=+290kJ/mol 0.04 不变 大于 大于 AB 增大容器容积(或减小压强) a(M)=a(N)>a(P)
2Cu2O(s)+O2(g) △H=+290kJ/mol 0.04 不变 大于 大于 AB 增大容器容积(或减小压强) a(M)=a(N)>a(P)
【解析】
(1)根据盖斯定律②×2-①得4CuO(s) ![]() 2Cu2O(s)+O2(g) △H=+314 kJ/mol×2-338 kJ/mol= +290kJ/mol。
2Cu2O(s)+O2(g) △H=+314 kJ/mol×2-338 kJ/mol= +290kJ/mol。
(2)①由信息,达到平衡时,Cu2O的物质的量为0.4mol,则参加反应的CuO的物质的量为0.8mol,生成O2的物质的量为0.2mol,K=c(O2)=0.2mol/5L=0.04mol/L5L②由于平衡常数只与温度有关,根据K=c(O2)得,缩小容器容积,平衡常数不变,重新达到平衡时O2的浓度不变。![]() 其他条件不变,起始向该容器中充人0.5molCuO,相当于减小压强,速率减慢,时间大于2.5min,该反应为气体分子总数增大的反应,减小压强,平衡正向移动,Cu2O的物质的量大于0.2mol。
其他条件不变,起始向该容器中充人0.5molCuO,相当于减小压强,速率减慢,时间大于2.5min,该反应为气体分子总数增大的反应,减小压强,平衡正向移动,Cu2O的物质的量大于0.2mol。
(3)碳与氧气反应放热,升高温度,反应速率加快,A项正确;气体生成容品使固体分散,有利于制得纳米级Cu2O,B项正确。CO将Cu2O还原为铜粉降低Cu2O的产率,C项错误;CO不是该反应的催化剂,D项错误,
Ⅱ(4)由图中信息,t1、t2、t3时改变的条件分别为增加CO浓度、增大容器容积(或减小压强)、升高温度。
(5)t2时,增加CO浓度,但该反应为气体分总数相等的反应,平衡时CO的转化率不变;t4时增大容器容积(或减小压强),平衡不移动,平衡时CO的转化率不变;由反应2CuO(s)=2Cu(s)+O2(g) △H=+314kJ·mol-1和2CO(g)+O2(g)=2CO2(g) △H=-565kJ·mol-1 得CuO(s)+CO(g)Cu(s)+CO2(g) △H=-126 kJ·mol-1,该反应放热,故t3时升高温度,平衡逆向移动,平衡时CO的转化率减小,则M、N、P三点对应状态下,CO的转化率a(M)、a(N)、a(P)的大小关系为a(M)=a(N)>a(P),

 阅读快车系列答案
阅读快车系列答案【题目】下列说法正确的是( )
A.汽油车在行驶过程中,热能首先转化为化学能,化学能再转化为动能
B.炸药发生爆炸时化学能完全转化为热能
C.炭燃烧时化学能主要转化为光能
D.柴草燃烧时,部分化学能转化为热能
【题目】软锰矿(主要成分为MnO2)可用于制备锰及其化合物,现代冶炼金属锰的工艺流程如下图所示,步骤中杂质离子逐一沉淀。

下表为t℃时,有关物质的Ksp
物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
Ksp | 4.0×10-38 | 2.2 | 5.5 | 1.9 | 6.3 | 9.1 | 2.5 | 2.2 |
软锰矿还原浸出的反应为:12MnO2+C6H12O6+12H2SO4===12MnSO4+6CO2↑+18H2O
(1)写出一种能提高还原浸出速率的措施:_________________________
(2)调节pH 步骤中生成的沉淀为________。加入MnF2的主要目的是除去__________ (填“Ca2+”、“Fe3+”或“Cu2+”)
(3)等浓度的(NH4)2S与(N4)2SO4 溶液中,NH4+的浓度大小为:前者________后者(填“>”、“< ” “=” )。
(4)由MnSO4制取MnCO3往MnSO4溶液中加入(NH4)2CO3溶液生成MnCO3,同时还会产生Mn(OH)2,可能的原因有:MnCO3(s)+2OH-(aq)![]() Mn(OH)2(s)+CO
Mn(OH)2(s)+CO![]() (aq),t℃时,计算该反应的平衡常数K=_________________(保留一位小数)。
(aq),t℃时,计算该反应的平衡常数K=_________________(保留一位小数)。