题目内容
下列关于化学反应的描述中正确的是 ( )。
| A.需要加热才能发生的反应一定是吸热反应 |
| B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,也放出57.3 kJ的热量 |
| C.CO(g)的燃烧热是283.0 kJ·mol-1,则表示CO(g)的燃烧热的热化学方程式为2CO(g)+O2(g)=2CO2(g) ΔH=-283.0 kJ·mol-1 |
| D.已知2C(s)+2O2(g)=2CO2(g) ΔH=a,2C(s)+O2(g)=2CO(g) ΔH=b,则b>a |
D
解析

练习册系列答案
相关题目
下列说法中不正确的是
| A.开发氢能、太阳能、风能、生物质能等是实现“低碳生活”的有效途径 |
| B.钢铁是用量最大、用途最广泛的合金 |
| C.硅主要以单质、氧化物、硅酸盐的形式存在于自然界中 |
| D.利用催化设施,可以将汽车尾气中CO和NO转化为无害气体 |
白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O=O dkJ·mol—1。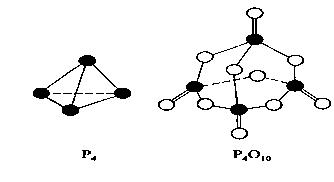
根据图示的分子结构和有关数据估算该反应的△H,其中正确的是
| A.(4c+12b-6a-5d)kJ·mol—1 |
| B.(6a+5d-4c-12b)kJ·mol—1 |
| C.(4c+12b-4a-5d)kJ·mol—1 |
| D.(4a+5d-4c-12b)kJ·mol—1 |
下列说法中正确的是
| A.同温同压下,H2(g)+Cl2(g)= 2HCl(g)在光照条件下和点燃条件下的ΔH不同 |
| B.常温下,2A(s)+B(g)= 2C(g)+D(g)不能自发进行,则该反应焓变一定大于零 |
| C.1mol硫酸与1molBa(OH)2完全中和所放出的热量为中和热 |
| D.在25℃、101KPa时,2mol S的燃烧热是1mol S的2倍 |
下列说法中错误的是( )
| A.电解饱和食盐水,生成物总能量比反应物总能量高 |
| B.化学反应过程中,发生物质变化的同时一定发生能量变化 |
| C.“冰,水为之,而寒于水”,说明相同质量的水和冰,水的能量高 |
| D.食盐可用于融化冰雪,且用食盐作融雪剂不会对环境、植物生长产生任何危害 |
下列说法正确的是( )。
A.反应A(g)  2B(g) ΔH,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则ΔH=(Ea-Eb) kJ·mol-1 2B(g) ΔH,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则ΔH=(Ea-Eb) kJ·mol-1 |
| B.标准状况下,向0.1 mol·L-1的氨水中加入少量氯化铵晶体,若混合溶液pH=7,则c(NH4+)=c(Cl-) |
| C.足量的锌铜合金与100 mL pH=1稀硫酸反应,反应3 s时测得pH=2,假设反应前后溶液的体积保持不变,则3 s内产生氢气的平均速率是33.6 mL·s-1 |
D.将浓度为0.1 mol·L-1 HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,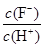 始终保持增大 始终保持增大 |
已知1 mol红磷转化为1 mol白磷,吸收18.39 kJ热量。
①4P(红,s)+5O2(g)=2P2O5(s);ΔH1
②P4(白,s)+5O2(g)=2P2O5(s);ΔH2
则ΔH1与ΔH2的关系正确的是( )
| A.ΔH1=ΔH2 | B.ΔH1>ΔH2 |
| C.ΔH1<ΔH2 | D.无法确定 |
已知下列热化学方程式:
①H2(g)+1/2O2(g)=H2O(g) ΔH1=a kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) ΔH2=b kJ·mol-1
③H2(g)+1/2O2(g)=H2O(l) ΔH3=c kJ·mol-1
④2H2(g)+O2(g)=2H2O(l) ΔH4=d kJ·mol-1
下列关系式中正确的是( )
| A.a<c<0 | B.b>d>0 |
| C.2a=b<0 | D.2c=d>0 |
在100 g炭不完全燃烧所得气体中CO和CO2的体积比为1∶2。已知:
C(s)+1/2O2(g)=CO(g) ΔH1=-110.35 kJ/mol
CO(g)+1/2O2 =CO2(g) ΔH2=-282.57 kJ/mol
则与100 g炭完全燃烧相比,损失的热量是( )
| A.392.93 Kj | B.2 489.42 kJ |
| C.784.92 kJ | D.3 274.3 kJ |