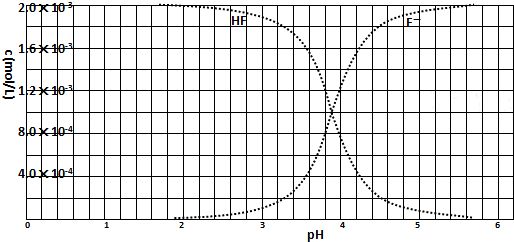
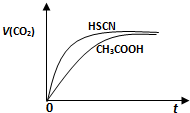
题目内容
将20mL 0.3mol/L AgNO3 溶液与10mL 0.4mol/LCaCl2溶液混合,所得溶液中离子浓度关系正确的是( )
分析:n(AgNO3)=0.3mol/L×0.02L=0.006mol,n(CaCl2)=0.4mol/L×0.01L=0.004mol,二者反应方程式为2AgNO3 +CaCl2═Ca(NO3)2+2AgCl↓,根据方程式知,硝酸银完全反应,剩余n(CaCl2)为0.001mol,所以溶液中的溶质是硝酸钙和氯化钙,n(Ca(NO3)2)=0.004mol,氯化钙和硝酸钙都是强酸强碱盐,在水溶液里完全电离,据此分析解答.
解答:解:n(AgNO3)=0.3mol/L×0.02L=0.006mol,n(CaCl2)=0.4mol/L×0.01L=0.004mol,二者反应方程式为2AgNO3 +CaCl2═Ca(NO3)2+2AgCl↓,根据方程式知,硝酸银完全反应,剩余n(CaCl2)为0.001mol,所以溶液中的溶质是硝酸钙和氯化钙,n(Ca(NO3)2)=0.004mol,氯化钙和硝酸钙都是强酸强碱盐,在水溶液里完全电离,根据物料守恒知,n(NO3- )=0.006mol,n(Cl-)=0.002mol,Ag+完全参加反应,n(Ca2+)=0.004mol,所以离子浓度大小顺序是c(NO3- )>c(Ca2+)>c(Cl-)>c(Ag+),故选A.
点评:本题考查了混合溶液中离子浓度大小的比较,明确混合溶液中的溶质是解本题关键,再结合物料守恒、电解质的电离程度比较溶液中的离子浓度,注意氯离子和银离子不能共存,为易错点.

练习册系列答案
相关题目
用20mL 0.05mol·L-1 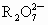 离子的溶液恰好能将20mL 0.3mol·L-1的Fe2+溶液完全氧化,则元素R在还原产物中的化合价为
离子的溶液恰好能将20mL 0.3mol·L-1的Fe2+溶液完全氧化,则元素R在还原产物中的化合价为
[ ]
|
A.+2 |
B.+3 |
|
C.+4 |
D.+5 |
 (2010?浙江)已知:
(2010?浙江)已知: