题目内容
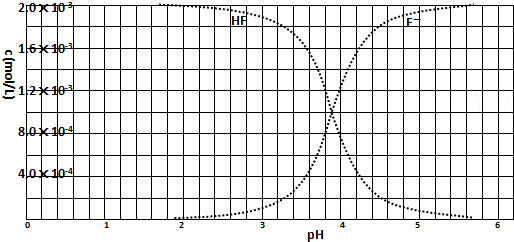
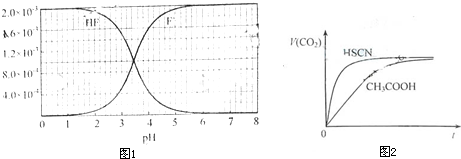
已知:①25℃时弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Ksp(CaF2)=1.5×10-10.②25℃时,2.0×10-3mol?L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
请根据信息回答下列问题: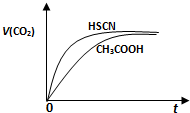
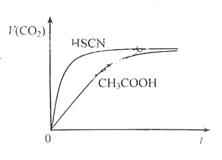
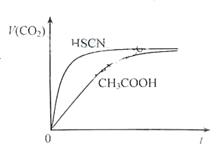
(1)25℃时,将20mL 0.10mol?L-1CH3COOH溶液和20mL 0.10mol?L-1HSCN溶液分别与20mL 0.10mol?L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如右图:
反应初始阶段,两种溶液产生CO2气体的速率存在
明显差异的原因是 ,反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”、“<”或“=”).
(2)25℃时,HF电离平衡常数的表达式Ka= ,25℃时,HF电离平衡常数Ka≈ .
(3)25℃时,将4.0×10-3 mol?L-1HF溶液与4.0×10-4 mol?L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生 .

请根据信息回答下列问题:

(1)25℃时,将20mL 0.10mol?L-1CH3COOH溶液和20mL 0.10mol?L-1HSCN溶液分别与20mL 0.10mol?L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如右图:
反应初始阶段,两种溶液产生CO2气体的速率存在
明显差异的原因是
(2)25℃时,HF电离平衡常数的表达式Ka=
(3)25℃时,将4.0×10-3 mol?L-1HF溶液与4.0×10-4 mol?L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生
分析:(1)根据酸的电离平衡常数来分析酸性的强弱,然后分析酸与盐反应的速率;再利用盐类水解的规律来分析离子浓度的关系;
(2)根据电离平衡常数的表达式和图中离子浓度的关系来分析电离平衡常数的数值;
(3)根据溶液中离子的浓度来计算离子浓度幂之积,利用离子积与溶度积常数的关系来判断是否有沉淀生成.
(2)根据电离平衡常数的表达式和图中离子浓度的关系来分析电离平衡常数的数值;
(3)根据溶液中离子的浓度来计算离子浓度幂之积,利用离子积与溶度积常数的关系来判断是否有沉淀生成.
解答:解:(1)由Ka(CH3COOH)=1.8×10-5和Ka(HSCN)=0.13可知,CH3COOH的酸性弱于HSCN的,即在相同浓度的情况下HSCN溶液中H+的浓度大于CH3COOH溶液中H+的浓度,浓度越大反应速率越快;又酸越弱,反应生成的相应的钠盐越易水解,即c(CH3COO-)<c(SCN-),
故答案为:HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快;<;
(2)已知氢氟酸的电离方程式:HF?H++F-,则Ka(HF)=
,当c(F-)和c(HF)相等时,由Ka(HF)=
,可知Ka(HF)=c(H+),由c(HF)、c(F-)与溶液pH的变化关系图可知,在c(F-)和c(HF)相等时图中pH=3.9,pH即为Ka(HF)的负对数,则Ka(HF)=10-3.9,
故答案为:
;10-3.9;
(3)25℃时,4.0×10-3 mol?L-1HF溶液与4.0×10-4 mol?L-1 CaCl2溶液等体积混合,则HF溶液浓度为2.0×10-3mol?L-1,CaCl2溶液浓度为2.0×10-4mol?L-1;查图知pH=4时,溶液中c(F-)浓度为1.6×10-3mol?L-1,
所以c(Ca2+)×c2(F-)=2.0×10-4×(1.6×10-3)2=5.12×10-10>Ksp(CaF2),有沉淀产生;
故答案为:有沉淀产生;
故答案为:HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快;<;
(2)已知氢氟酸的电离方程式:HF?H++F-,则Ka(HF)=
| c(H+)?c(F-) |
| c(HF) |
| c(H+)?c(F-) |
| c(HF) |
故答案为:
| c(H+)?c(F-) |
| c(HF) |
(3)25℃时,4.0×10-3 mol?L-1HF溶液与4.0×10-4 mol?L-1 CaCl2溶液等体积混合,则HF溶液浓度为2.0×10-3mol?L-1,CaCl2溶液浓度为2.0×10-4mol?L-1;查图知pH=4时,溶液中c(F-)浓度为1.6×10-3mol?L-1,
所以c(Ca2+)×c2(F-)=2.0×10-4×(1.6×10-3)2=5.12×10-10>Ksp(CaF2),有沉淀产生;
故答案为:有沉淀产生;
点评:本题考查电离平衡常数与弱电解质的电离、盐类水解的关系及利用溶度积来分析是否有沉淀生成,明确电离平衡常数的表达式和离子积的计算,并借助图来分析解答即可,较好的训练学生利用信息来分析问题、解决问题的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
(14分)已知:①25℃时弱电解质电离平衡数:Ka(CH3COOH)=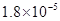 ,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=
,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=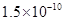
②25℃时,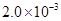 mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示: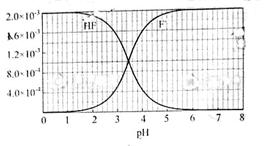
请根据以下信息回答下列问题:
(1)25℃时,HF电离平衡常数的数值Ka= 。
(2)25℃时,将20mL 0.10 mol·L-1 CH3COOH溶液和20mL 0.10 mol·L-1HSCN溶液分别与20mL 0.10 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 ,反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”、“<”或“=”)
(3)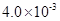 mol·L-1HF溶液与
mol·L-1HF溶液与 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化), (填“有”或“无”)沉淀产生。
mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化), (填“有”或“无”)沉淀产生。
(4)已知CH3COONH4溶液为中性,又知CH3COOH溶液加到Na2CO3溶液中有气体放出,试推断NH4HCO3溶液的pH 7(填“>”、“<”或“=”);
将同温度下等浓度的四种盐溶液:?
| A.NH4Cl | B.NH4SCN? | C.CH3COONH4 | D.NH4HCO3 |
按pH由大到小的顺序排列是: (填序号)
 (2010?浙江)已知:
(2010?浙江)已知:
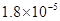 ,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=
,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=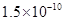
 mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示: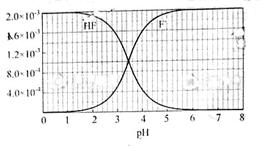
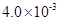 mol·L-1HF溶液与
mol·L-1HF溶液与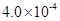 mol·L-1
CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化), (填“有”或“无”)沉淀产生。
mol·L-1
CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化), (填“有”或“无”)沉淀产生。