题目内容
17.NA表示阿伏加德罗常数,下列叙述中正确的是( )| A. | 物质的量浓度为0.5mol/L MgCl2溶液,含有氯离子数为NA | |
| B. | 25℃、1.01×105Pa时,22gCO2中含有0.5NA个原子 | |
| C. | 46g NO2与N2O4混合气体中含有原子数为3NA | |
| D. | 将98g H2SO4溶解于500mL水中,所得溶液中H+的物质的量浓度为4 mol/L |
分析 A、溶液体积不明确;
B、求出二氧化碳的物质的量,然后根据1mol二氧化碳中含3mol原子来分析;
C、NO2与N2O4的最简式均为NO2;
D、将硫酸溶于500mL水中,溶液体积大于500mL.
解答 解:A、溶液体积不明确,故溶液中的氯离子的个数无法计算,故A错误;
B、22g二氧化碳的物质的量n=$\frac{22g}{44g/mol}$=0.5mol,而1mol二氧化碳中含3mol原子,故0.5mol二氧化碳中含1.5NA个原子,故B错误;
C、NO2与N2O4的最简式均为NO2,故46g混合物中含有的NO2的物质的量n=$\frac{46g}{46g/mol}$=1mol,则含3mol原子即3NA个,故C正确;
D、将硫酸溶于500mL水中,溶液体积大于500mL,则氢离子的浓度小于4mol/L,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
2.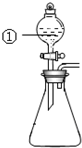 用如图所示装置进行下列实验:将①中溶液滴入锥形瓶中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入锥形瓶中,预测的现象与实际相符的是( )
 用如图所示装置进行下列实验:将①中溶液滴入锥形瓶中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入锥形瓶中,预测的现象与实际相符的是( )| 选项 | ①中物质 | 锥形瓶中物质 | 预测锥形瓶中的现象 |
| A | 浓盐酸 | “84”消毒液 | 有黄绿色气体产生 |
| B | 浓硝酸 | 光洁的铁钉 | 产生红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 先有白色沉淀生成, 后沉淀又溶解 |
| D | 草酸溶液 | 酸性高锰酸钾溶液 | 溶液逐渐褪色, 有黑色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
6.下列化学用语表述不正确的是( )
| A. | 水解方程式 HCO${\;}_{3}^{-}$+H2O═H2CO3+H3O+ | |
| B. | 水的电离 2H20?H3O++OH- | |
| C. | 醋酸的电离方程式CH3COOH+H2O?CH3COO-+H3O+ | |
| D. | 水解方程式 HCO${\;}_{3}^{-}$+H2O?H2CO3+OH- |
7.下列有关化学用语的表示方法中正确的是( )
| A. | H2O2的电子式: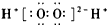 | B. | CO2分子的结构式:O=C=O | ||
| C. | 原子核内有8个中子的碳原子:$\stackrel{14}{8}$C | D. | 氯化钠的分子式:NaCl |
 请认真观察图,然后回答问题:
请认真观察图,然后回答问题: