题目内容
7.KMnO4是一种重要的氧化剂.在酸性条件下KMnO4的氧化性会增强.2KMnO4+5H2C2O4+3H2SO4═2MnSO4+K2SO4+8H2O+10CO2↑
①该反应中氧化剂是KMnO4、氧化产物CO2.
②有0.2mol KMnO4参加反应电子转移数目是NA个.
分析 2KMnO4+5H2C2O4+3H2SO4═2MnSO4+K2SO4+8H2O+10CO2↑中,Mn元素的化合价降低,C元素的化合价升高,该反应转移10e-,以此来解答.
解答 解:①Mn元素的化合价降低,则氧化剂为KMnO4,C元素的化合价升高,失去电子被氧化,则对应氧化产物为CO2,故答案为:KMnO4;CO2;
②由Mn元素从+7价降低为+5价可知,0.2mol KMnO4参加反应电子转移数目是0.2mol×(7-2)×NA=NA,故答案为:NA.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及转移电子计算方法为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
18.黑火药爆炸时可发生如下反应:4S+16KNO3+16C═3K2SO4+4K2CO3+K2S+12CO2↑+8N2↑,下列有关说法正确的是( )
| A. | 消耗128g S时,反应转移的电子总物质的量为164mol | |
| B. | 消耗12gC时,反应转移4mol电子 | |
| C. | 被氧化和被还原的硫原子之比为3:1 | |
| D. | KNO3发生了氧化反应 |
2.将pH=1的稀硫酸慢慢加入一定量的BaCl2的溶液中,恰好使Ba2+沉淀完全,(混合时溶液体积可近似为直接相加),反应后混合溶液的pH=2,则原BaCl2溶液中Cl-的浓度为( )
| A. | 0.11mol/L | B. | 0.22mol/L | C. | 0.011mol/L | D. | 0,.022mol/L |
19.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4LN2中含有的原子数为NA | |
| B. | 标准状况下,11.2 L CCl4中含有的分子数为0.5 NA | |
| C. | 物质的量浓度为1 mol•L-1的K2SO4溶液中,含2 NA个K+ | |
| D. | 23g Na与足量H2O反应转移的电子数为NA |
17.NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 物质的量浓度为0.5mol/L MgCl2溶液,含有氯离子数为NA | |
| B. | 25℃、1.01×105Pa时,22gCO2中含有0.5NA个原子 | |
| C. | 46g NO2与N2O4混合气体中含有原子数为3NA | |
| D. | 将98g H2SO4溶解于500mL水中,所得溶液中H+的物质的量浓度为4 mol/L |
 (R、R′代表烃基)
(R、R′代表烃基) .
.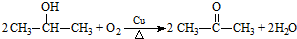 .
.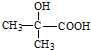 .
.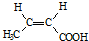 .
.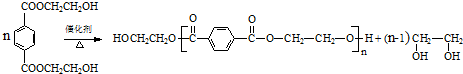 .
.