题目内容
下表标出的是元素周期表的一部分元素,回答下列问题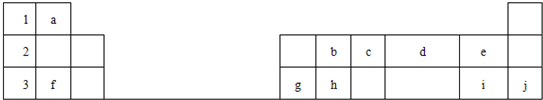
(1)表中列出的10种元素中,化学性质最不活泼的是
(2)分子bd2的电子式
 ,元素e的负一价阴离子的结构示意图
,元素e的负一价阴离子的结构示意图
 .
.
(3)物质bd2和hd2在物理性质上有着巨大差异,其原因是物质bd2属于
(4)元素e的气态氢化物比元素i的气态氢化物
(5)元素f、g的最高价氧化物对应水化物之间反应的离子方程式是
(6)物质fda含有的化学键类型是

(1)表中列出的10种元素中,化学性质最不活泼的是
氩
氩
(填元素名称,下同),非金属性最强的是氟
氟
,原子半径最小的是氢
氢
.(2)分子bd2的电子式




(3)物质bd2和hd2在物理性质上有着巨大差异,其原因是物质bd2属于
分子
分子
晶体,物质hd2属于原子
原子
晶体.(4)元素e的气态氢化物比元素i的气态氢化物
稳定
稳定
(填“稳定”或“不稳定”)(5)元素f、g的最高价氧化物对应水化物之间反应的离子方程式是
Al(OH)3+OH-=[Al(OH)4]-
Al(OH)3+OH-=[Al(OH)4]-
;(6)物质fda含有的化学键类型是
离子键和共价键
离子键和共价键
.分析:(1)稀有气体元素化学性质稳定,根据元素周期律知识来确定非金属性和原子半径的大小;
(2)根据二氧化碳的结构和离子的核外电子排布知识来回答;
(3)分子晶体的熔点低于原子晶体;
(4)同主族元素的原子,从上到下氢化物越来越稳定;
(5)氢氧化铝是两性氢氧化物,能和强碱反应;
(6)根据氢氧化钠中的成键元素来回答.
(2)根据二氧化碳的结构和离子的核外电子排布知识来回答;
(3)分子晶体的熔点低于原子晶体;
(4)同主族元素的原子,从上到下氢化物越来越稳定;
(5)氢氧化铝是两性氢氧化物,能和强碱反应;
(6)根据氢氧化钠中的成键元素来回答.
解答:解:根据元素在周期表中的分布知识,可以确定a是H,b是C,c是N,d是O,e是F,f是Na,g是Al,h是Si,i是Cl,j是Ar.
(1)表中列出的10种元素中,稀有气体元素Ar化学性质稳定,同一周期,元素原子半径从左到右半径在减小,同一主族元素的原子半径从上到下逐渐增大;所以原子半径最小的是H,同周期元素的原子从左到右,元素的非金属性逐渐增强,同一主族,元素的原子从上到下,元素的非金属性逐渐减弱,所以费金属性最强的是F,故答案为:氩;氟;氢;
(2)二氧化碳是碳原子和氧原子之间通过共价双键形成的共价化合物,电子式为: ,氟离子核外电子数为10,离子的结构示意图为:
,氟离子核外电子数为10,离子的结构示意图为: ,故答案为:
,故答案为: ;
; ;
;
(3)二氧化碳是分子晶体,二氧化硅是原子晶体,分子晶体的熔点低于原子晶体,故答案为:分子;原子;
(4)同主族元素的原子,从上到下氢化物越来越稳定,所以元素F的气态氢化物比元素Cl的气态氢化物稳定,故答案为:稳定;
(5)元素f的最高价氧化物对应水化物是氢氧化钠,g的最高价氧化物对应水化物是氢氧化铝,氢氧化铝是两性氢氧化物,能和强碱反应,实质是:Al(OH)3+OH-=[Al(OH)4]-,故答案为:Al(OH)3+OH-=[Al(OH)4]-;
(6)氢氧化钠中钠离子和氢氧根之间是离子键,氧和氢之间是共价键,故答案为:离子键和共价键.
(1)表中列出的10种元素中,稀有气体元素Ar化学性质稳定,同一周期,元素原子半径从左到右半径在减小,同一主族元素的原子半径从上到下逐渐增大;所以原子半径最小的是H,同周期元素的原子从左到右,元素的非金属性逐渐增强,同一主族,元素的原子从上到下,元素的非金属性逐渐减弱,所以费金属性最强的是F,故答案为:氩;氟;氢;
(2)二氧化碳是碳原子和氧原子之间通过共价双键形成的共价化合物,电子式为:
 ,氟离子核外电子数为10,离子的结构示意图为:
,氟离子核外电子数为10,离子的结构示意图为: ,故答案为:
,故答案为: ;
; ;
;(3)二氧化碳是分子晶体,二氧化硅是原子晶体,分子晶体的熔点低于原子晶体,故答案为:分子;原子;
(4)同主族元素的原子,从上到下氢化物越来越稳定,所以元素F的气态氢化物比元素Cl的气态氢化物稳定,故答案为:稳定;
(5)元素f的最高价氧化物对应水化物是氢氧化钠,g的最高价氧化物对应水化物是氢氧化铝,氢氧化铝是两性氢氧化物,能和强碱反应,实质是:Al(OH)3+OH-=[Al(OH)4]-,故答案为:Al(OH)3+OH-=[Al(OH)4]-;
(6)氢氧化钠中钠离子和氢氧根之间是离子键,氧和氢之间是共价键,故答案为:离子键和共价键.
点评:本题考查学生元素周期表的结构和元素周期律知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目

