题目内容
实验室需配制一种c (H+)=2mol/L的强酸溶液500mL,下列配制方法可行的是( )
| A.取100mL5mol/LH2SO4,加入400mL水 |
| B.取200mL5mol/LHCl,加水稀释至500mL |
| C.取200 mL5mol/LH2SO4,加水稀释至500mL |
| D.取100 mL5mol/LHNO3,加水稀释至500mL |
B
解析试题分析:A溶液的体积不等于原溶液的体积与加入的水的体积之和,错误。B利用稀释公式C1V1=C2V2可得C2=2mol/L,C(H+)="C(HCl)" =2mol/L,正确。C利用稀释公式可得稀释后C(H2SO4)=" 2mol/L," C(H+)=2C(H2SO4)= 4mol/L,错误。D中,C(H+)=1mol/L,错误。
考点:考查关于溶液的稀释、电解质的电离等问题的知识。

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
质量相同的Na、Mg、Al、Zn分别放入足量的稀盐酸中,在相同的条件下,产生氢气最多的是
| A.Na | B.Mg | C.Al | D.Zn |
用NA表示阿伏伽德罗常数,下列说法正确的是
| A.反应KClO3+6HCl=KCl+3Cl2↑+ 3H2O中,每生成1molCl2转移的电子为2NA |
| B.1molC8H18分子中含有的共用电子对数为26NA |
| C.在0℃,101kPa,1molSO3中含有NA个硫原子 |
| D.0.5L0.1mol/LNH4Cl溶液中含NH4+离子的数目为0.05NA |
下列各组数值或物理量中,都不随水的“物质的量”的变化而变化的是
| A.水的沸点;水分子的数目 | B.水的密度;水的摩尔质量 |
| C.水的体积;水中所含原子的数目 | D.水的质量;水的相对分子质量 |
把VL含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡;另一份加入含b mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁。则原混合溶液中钾离子的浓度为
A.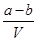 mol·L-1 mol·L-1 | B.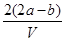 mol·L-1 mol·L-1 |
C. mol·L-1 mol·L-1 | D.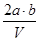 mol·L-1 mol·L-1 |
在标况下,下列气体含有的分子数最多的是
| A.36.5g HCl | B.4 mol H2O | C.4g H2 | D.0.5mol SO2 |
下列说法正确的是
| A.在标准状况下,1mol水的体积是22.4L |
B.1mol 所占的体积一定是22.4L 所占的体积一定是22.4L |
C.1L0.5mol/L的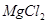 溶液中,含有 溶液中,含有 的个数为 的个数为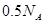 |
D.在标准状况下,总质量为28g的 和CO的混合气体,其体积约为22.4L 和CO的混合气体,其体积约为22.4L |
下列有关化学用语使用正确的是
A.CO2的电子式: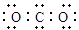 |
| B.次氯酸的结构式:H—O—Cl |
C.中子数为18的氯原子结构示意图: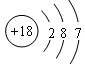 |
| D.二氧化硅的分子式为:SiO2 |