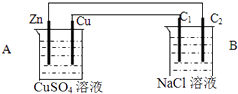
题目内容
【题目】铁、稀盐酸、澄清石灰水、氯化铜溶液是常见的物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
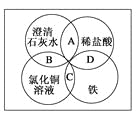
A. OH-+HCl===H2O+Cl-
B. Ca(OH)2+Cu2+===Ca2++Cu(OH)2
C. Fe+Cu2+===Cu+Fe2+
D. Fe+2H+===Fe3++H2↑
【答案】C
【解析】A中盐酸是强酸,在溶液中应拆成离子形式,正确的离子方程式为H++OH-===H2O;B中澄清石灰水中Ca(OH)2应拆成离子形式,正确的离子方程式为2OH-+Cu2+===Cu(OH)2↓;C中铁能置换出氯化铜中的铜,原子守恒,电荷也守恒,正确;D中铁与稀盐酸反应生成
Fe2+,正确的离子方程式为Fe+2H+===Fe2++H2↑。故正确答案为C。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案【题目】高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)△H=a kJ mol﹣1
(1)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ mol﹣1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ mol﹣1
则a=kJ mol﹣1 .
(2)冶炼铁反应的平衡常数表达式K= , 温度升高后,K值(填“增大”、“不变”或“减小”).
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
Fe2O3 | CO | Fe | CO21 | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
①甲容器中CO的平衡转化率为 .
②下列说法正确的是(填字母).
a.若容器内气体密度恒定时,标志反应达到平衡状态 b.甲容器中CO的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2:3 d.增加Fe2O3可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀.下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液.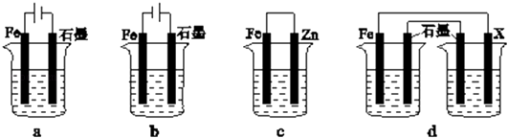
①在a~c装置中,能保护铁的是(填字母).
②若用d装置保护铁,X极的电极材料应是(填名称).