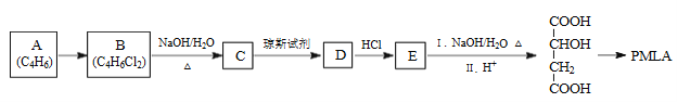
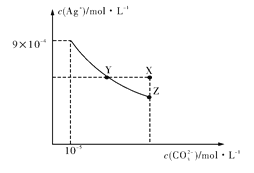
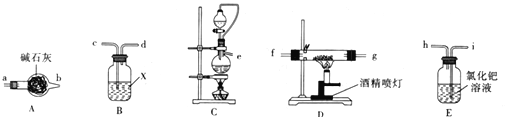
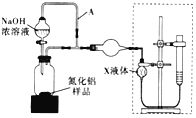
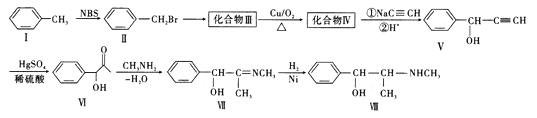
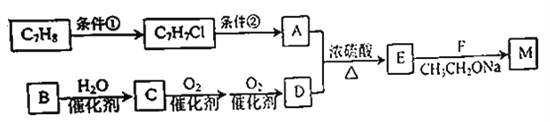
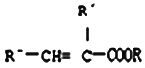题目内容
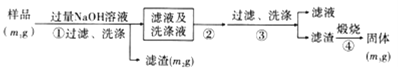
【题目】部分被氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:
下列说法正确的是

A. V=448 B. 样品中CuO的质量为4.0 g
C. 滤液A中的阳离子为Fe2+、Fe3+、H+ D. 样品中Fe元素的质量为2.14 g
【答案】A
【解析】样品发生反应:Fe2O3+6H+=2Fe3++3H2O,CuO+2H+=Cu2++H2O,2Fe3++Fe=3Fe2+ ,Fe+Cu2+= Fe2++Cu,Fe+2H+= Fe2++H2↑。A.消耗的硫酸最终转化为FeSO4,铁元素的物质的量为0.04mol,对应消耗硫酸0.04mol,提供H+0.08mol,部分 H+和合金中的氧结合成水,其余的H+成为氢气,合金中氧元素的物质的量为(5.76-3.2-2.24)g/16g/mol =0.02mol,结合的氢离子为0.04mol,所以硫酸中有(0.08-0.04)mol=0.04molH+生成氢气,即生成0.02mol氢气,标准状况下的体积为448mL,故A正确;B.5.76g样品含2.24g铁,所以CuO质量不超过(5.76-2.24)g=3.52g,故B错误;C. 氧化性Fe3+> H+,当生成氢气时,说明溶液中已经没有Fe3+,故C错误;D. 氧化性 Cu2+> H+,当生成氢气时,说明溶液中已经没有Cu2+,从滤液A得到的3.2g固体为氧化铁,其物质的量为 3.2g/160g/mol =0.02mol,其中铁元素的物质的量为0.02mol×2=0.04mol,质量为0.04mol×56g/mol=2.24g,故D错误;故选A。

【题目】控制和治理SO2、NOx是减少酸雨和光化学烟雾的有效途径。
(1)烟气脱琉是大气污染防治研究的热点。脱硫过程涉及的反应如下:
SO2(g)+H2O(l)+HC1O(aq)![]() H2SO4(aq)+HCl(aq) △H=a kJmol-1;
H2SO4(aq)+HCl(aq) △H=a kJmol-1;
Ca(ClO)2(aq)+H2SO4(aq) ![]() CaSO4(s)+2HClO(aq) △H=b kJmol-1。
CaSO4(s)+2HClO(aq) △H=b kJmol-1。
则脱疏反应:Ca(ClO)2(aq)+ 2SO2(g) + 2H2O(l)![]() CaSO4(s)+ H2SO4(aq) + 2HClO(aq)的△H=______(用含a、b的代数式表示) kJmol-1。
CaSO4(s)+ H2SO4(aq) + 2HClO(aq)的△H=______(用含a、b的代数式表示) kJmol-1。
(2)100℃时,向一个1 L的恒容密闭容器中充入0.2 mol NO2,发生反应:2NO2(g)![]() N2O4(g) △H<0。测得不同时间时容器中NO2的浓度如下表所示。
N2O4(g) △H<0。测得不同时间时容器中NO2的浓度如下表所示。
时间/min | 0 | t1 | t2 | t3 | t4 |
c(NO2)/mol·L-1 | 0.2 | 0.16 | 0.13 | 0.12 | 0.12 |
①在0~t3时间段内,N2O4的平均反应速率为______molL-1min-1,NO2的平衡转化率为________。
②100℃时,该反应的平衡常数K=____________。