题目内容
PbO2及2PbCO3·Pb(OH)2(碱式碳酸铅)均是生产铅酸蓄电池正极的原料。
(1)PbO2可由NaClO氧化Pb(NO3)2溶液得到。
①Pb(NO3)2被氧化为PbO2的离子方程式为 。
②Pb(NO3)2溶液中通入H2S发生Pb2+(aq)+H2S(aq) PbS(s)+2H+(aq),直至平衡,该反应的平衡常数为K= [已知:Ksp(PbS)= 3.55×10-28;H2S电离常数Ka1=1.3×10-7,Ka2=7.1×10-15 ]。
PbS(s)+2H+(aq),直至平衡,该反应的平衡常数为K= [已知:Ksp(PbS)= 3.55×10-28;H2S电离常数Ka1=1.3×10-7,Ka2=7.1×10-15 ]。
(2)制备碱式碳酸铅的实验步骤如下:
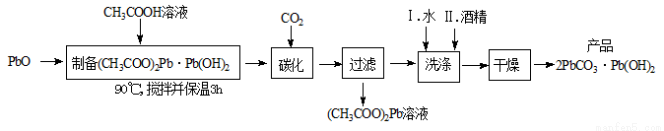
①“碳化”时,发生反应的化学方程式为 。
②“洗涤”时,经水洗涤后再用酒精洗涤的目的是 。
(3)为确定2PbCO3·Pb(OH)2(相对式量:775)的热分解过程,进行如下实验:称取一定量(2)实验制得的样品放在热重分析仪中,在氩气流中热分解,测得样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如下图所示。
①A→B过程中,从体系中逸出的分解产物(化合物)为 (填化学式);C→D过程中,从体系中逸出的分解产物(化合物)为 (填化学式)。
②根据图中实验数据,计算并确定E点残留固体的化学式(写出计算过程)。
练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目




 应的叙述相符的是( )
应的叙述相符的是( )