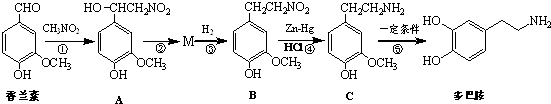
题目内容
【题目】将13.0g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生气体6.72L(标况).另取等质量的合金溶于过量的稀硝酸中生成6.72L(标况)NO,向反应后的溶液中加入过量的NaOH溶液,得到沉淀的质量是( )
A.11.85g
B.12.7g
C.27.45g
D.28.3g
【答案】B
【解析】解:合金溶于足量的NaOH溶液中,金属铝和氢氧化钠反应产生气体氢气6.72L(标准状况),物质的量为 ![]() =0.3mol,根据电子转移守恒可知n(Al)=
=0.3mol,根据电子转移守恒可知n(Al)= ![]() =0.2mol,故金属铝的质量为0.2mol×27g/mol=5.4g,金属铝提供电子的量是0.6mol,将合金溶于过量稀硝酸中,分别生成Al3+、Fe3+、Cu2+离子,根据电子守恒,金属共提供电子的物质的量为
=0.2mol,故金属铝的质量为0.2mol×27g/mol=5.4g,金属铝提供电子的量是0.6mol,将合金溶于过量稀硝酸中,分别生成Al3+、Fe3+、Cu2+离子,根据电子守恒,金属共提供电子的物质的量为 ![]() ×3=0.9mol,故Fe、Cu共提供的电子物质的量为0.9mol﹣0.6mol=0.3mol,向反应后的溶液中加入过量的NaOH溶液,铝离子全部转化为偏铝酸根离子,不会出现沉淀,所得沉淀为氢氧化铁、氢氧化铜,由电荷守恒可知,反应中金属铁、铜提供的电子的物质的量等于生成碱的氢氧根离子的物质的量,即n(OH﹣)=0.3mol,所以反应后沉淀的质量等于13.0g﹣5.4g+0.3mol×17g/mol=12.7g,
×3=0.9mol,故Fe、Cu共提供的电子物质的量为0.9mol﹣0.6mol=0.3mol,向反应后的溶液中加入过量的NaOH溶液,铝离子全部转化为偏铝酸根离子,不会出现沉淀,所得沉淀为氢氧化铁、氢氧化铜,由电荷守恒可知,反应中金属铁、铜提供的电子的物质的量等于生成碱的氢氧根离子的物质的量,即n(OH﹣)=0.3mol,所以反应后沉淀的质量等于13.0g﹣5.4g+0.3mol×17g/mol=12.7g,
故选B.

练习册系列答案
相关题目