题目内容
在一定条件下,二氧化硫和氧气发生 如下反应:
2SO2(g)+ O2 (g)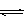 2SO3(g) (△H< 0)
2SO3(g) (△H< 0)
(1)降低温度,二氧化硫转化率_________,化学反应速率_ (以上均填增大、减小或不变)
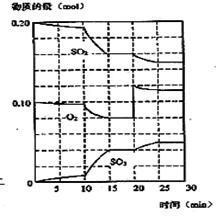
(2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间____ 。
(3)据图判断,反应进行至20min时,曲线发生变化的原因是__ ___(用文字表达)
(4)10min到15min的曲线变化的原因可能是 __________________(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
2SO2(g)+ O2 (g)
 2SO3(g) (△H< 0)
2SO3(g) (△H< 0)
(1)降低温度,二氧化硫转化率_________,化学反应速率_ (以上均填增大、减小或不变)
(2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间____ 。
(3)据图判断,反应进行至20min时,曲线发生变化的原因是__ ___(用文字表达)
(4)10min到15min的曲线变化的原因可能是 __________________(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
(1)增大,减小
(2)15—20min和25—30min。
(3)增加了O2的浓度 (4)a 、 b
(2)15—20min和25—30min。
(3)增加了O2的浓度 (4)a 、 b
试题分析:(1)正反应为放热反应,降低温度,平衡右移,SO2转化率降低,反应速率减小;(2)处于平衡状态,即各物质的物质的量浓度不再变化;(3)反应进行至20min时,氧气的浓度骤增,SO2和SO3浓度不变,故此时是增加了O2的浓度;(4)10min到15min中,单位时间内各物质的浓度的变化量增大,则反应速率增大;加入催化剂,缩小容器容积,增大压强,升高温度,增大某气体的浓度,都可以加大反应速率;但是增加SO3的物质的量,图中SO3的浓度应该骤增,而不是逐渐增大,故d不符合。
点评:化学平衡与化学速率是历年高考必考知识点,考生在备考过程中要注意分别两者的影响因素。

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
 H2(g)+I2(g)已达平衡状态的是
H2(g)+I2(g)已达平衡状态的是 
 2 SO3 达到平衡的标志是
2 SO3 达到平衡的标志是 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( ) 2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。
2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。 cZ(g)
cZ(g) 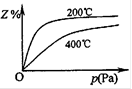

 pC(g)+qD(g)中,当m、n、p、q为任意正整数时,达到平衡的标志是( )
pC(g)+qD(g)中,当m、n、p、q为任意正整数时,达到平衡的标志是( )