题目内容
16.苯二甲酸有多种同分异构体,其中含苯环且核磁共振氢谱有3个峰的有( )| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
分析 苯二甲酸的同分异构体中含有苯环且核磁共振氢谱有三个峰,调整羧基的位置,然后官能团异构-变换酯基、醛基的位置即可解答.
解答 解:苯二甲酸的同分异构体中含有苯环且核磁共振氢谱有三个峰的有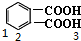 、
、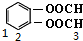 、
、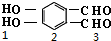 、
、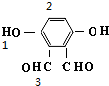 、
、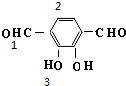 共5种;
共5种;
故选D.
点评 本题考查同分异构体的书写,找到官能团并变换位置是解题的关键,难度不大.

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
6.北京大学和中国科学院的化学工作者合作已成功研制出碱金属与C60形成的球碳盐K3C60实验测知该物质属于离子化合物,且有良好的超导性,下列关于K3C60的组成和结构的分析正确的是( )
| A. | K3C60中既有离子键,又有极性共价键 | |
| B. | 该物质在熔融状态下能导电 | |
| C. | 该物质的化学式可写成KC20 | |
| D. | 1molK3C60中含有的共价键的数目约为60×6.02×1023个 |
7.质量相同的N2O4和NO2中,下列说法正确的是( )
| A. | 氮元素的质量比是1:2 | B. | 氮元素的物质的量之比是1:1 | ||
| C. | N2O4和NO2的分子数之比是1:1 | D. | 氧原子个数之比是2:1 |
4. 碳、氮的化合物在工农业生产中应用广泛.
碳、氮的化合物在工农业生产中应用广泛.
(1)在一定条件下,联氨(N2H4)与H2O2反应生成N2和H2O.反应过程中的能量变化如图所示.该反应属于放热反应.(填写“吸热反应”或“放热反应”).
甲胺(CH3NH2)在水溶液中发生反应:CH3NH2+H2O?CH3NH2.H2O?CH3CH3++OH-,
CH3NH3Cl溶液中离子浓度的大小顺序为c(Cl-)>c(CH3NH3+)>c(H+)>c(OH-).
(2)工业上可采用CO与H2合成甲醇,反应方程式为:CO(g)+2H2(g)?CH3OH(g)△H<0
T1℃时,在容积为2L的两个密闭容器中充入CO、H2进行实验,反应过程中部分数据如下表所示:
①实验I前10min内的平均反应速率v(H2)=0.06mol•L-1•min-1.
②对于实验I,20min时反应达平衡,其它条件不变,若向容器中再充入0.1molCO(g)和0.2mol CH3OH(g),则平衡逆向移动(填“正向”、“逆向”或“不”);若将温度变为T2℃,再次达到平衡时CH3OH的物质的量为1.2mol,则CO的转化率为60%.
③实验I、Ⅱ均达到平衡时,平衡常数KI>KⅡ(填“>”、“<”或“=”).
(3)T℃时,将碳酸钡加入Na2SO4溶液中,沉淀发生转化,写出反应的离子方程式BaCO3(s)+SO42-(aq)=BaSO4(s)+CO32-(aq).反应后过滤,所得滤液呈碱性(填写“碱性”、“酸性”或“中性”).
 碳、氮的化合物在工农业生产中应用广泛.
碳、氮的化合物在工农业生产中应用广泛.(1)在一定条件下,联氨(N2H4)与H2O2反应生成N2和H2O.反应过程中的能量变化如图所示.该反应属于放热反应.(填写“吸热反应”或“放热反应”).
甲胺(CH3NH2)在水溶液中发生反应:CH3NH2+H2O?CH3NH2.H2O?CH3CH3++OH-,
CH3NH3Cl溶液中离子浓度的大小顺序为c(Cl-)>c(CH3NH3+)>c(H+)>c(OH-).
(2)工业上可采用CO与H2合成甲醇,反应方程式为:CO(g)+2H2(g)?CH3OH(g)△H<0
T1℃时,在容积为2L的两个密闭容器中充入CO、H2进行实验,反应过程中部分数据如下表所示:
| 序号 | 实验条件 | 反应时间 | CO(g)/mol | H2(g)/mol | CH3OH(g)/mol |
| 实验Ⅰ | 恒温恒容 | 0min | 2 | 4 | 0 |
| 10min | 2.8 | ||||
| 20min | 1 | ||||
| 实验Ⅱ | 绝热恒容 | 0min | 2 | 4 | 0 |
②对于实验I,20min时反应达平衡,其它条件不变,若向容器中再充入0.1molCO(g)和0.2mol CH3OH(g),则平衡逆向移动(填“正向”、“逆向”或“不”);若将温度变为T2℃,再次达到平衡时CH3OH的物质的量为1.2mol,则CO的转化率为60%.
③实验I、Ⅱ均达到平衡时,平衡常数KI>KⅡ(填“>”、“<”或“=”).
(3)T℃时,将碳酸钡加入Na2SO4溶液中,沉淀发生转化,写出反应的离子方程式BaCO3(s)+SO42-(aq)=BaSO4(s)+CO32-(aq).反应后过滤,所得滤液呈碱性(填写“碱性”、“酸性”或“中性”).
11. 近年来全国各地长期被雾霾笼罩,雾霾颗粒中汽车尾气占20%以上.已知汽车尾气中的主要污染物为NOx、CO、燃烧源超细颗粒(PM2.5)等由害物质.目前,已研究出了多种消除汽车尾气污染的方法.
近年来全国各地长期被雾霾笼罩,雾霾颗粒中汽车尾气占20%以上.已知汽车尾气中的主要污染物为NOx、CO、燃烧源超细颗粒(PM2.5)等由害物质.目前,已研究出了多种消除汽车尾气污染的方法.
(1)催化剂存在时用H2将NO还原为N2.
已知:
则H2还原NO生成氮气和水蒸气的热化学方程式是:2NO(g)+2H2(g)═N2(g)+2H2O(g)△H=-665 kJ•mol-1.
(2)用活性炭还原处理氮氧化物,有关反应为
C(s)+2NO(g)?N2(g)+CO2(g)△H
在2L恒容密闭器中加入足量的C与NO反应,所得实验数据如表
①写出该反应的平衡常数表达式$\frac{c({N}_{2})c(C{O}_{2})}{{c}^{2}(NO)}$.
②结合表中数据,判断该反应的△H>0(填“>”或“<”),理由是计算700°C和800°C的平衡常数K1<K2,所以△H>0.
③实验3达到平衡时,NO的转化率为67%.(保留2位有效数字)
④根据实验2数据,假设反应在t1时刻达到平衡,若t2时刻保持温度不变,将容器体积压缩至原来一半,请在图中作出整个过程中CO2的体积分数(CO2)随时间变化的曲线.
 近年来全国各地长期被雾霾笼罩,雾霾颗粒中汽车尾气占20%以上.已知汽车尾气中的主要污染物为NOx、CO、燃烧源超细颗粒(PM2.5)等由害物质.目前,已研究出了多种消除汽车尾气污染的方法.
近年来全国各地长期被雾霾笼罩,雾霾颗粒中汽车尾气占20%以上.已知汽车尾气中的主要污染物为NOx、CO、燃烧源超细颗粒(PM2.5)等由害物质.目前,已研究出了多种消除汽车尾气污染的方法.(1)催化剂存在时用H2将NO还原为N2.
已知:

则H2还原NO生成氮气和水蒸气的热化学方程式是:2NO(g)+2H2(g)═N2(g)+2H2O(g)△H=-665 kJ•mol-1.
(2)用活性炭还原处理氮氧化物,有关反应为
C(s)+2NO(g)?N2(g)+CO2(g)△H
在2L恒容密闭器中加入足量的C与NO反应,所得实验数据如表
| 实验编号 | 温度/°C | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
| 1 | 700 | 0.40 | 0.09 |
| 2 | 800 | 0.24 | 0.08 |
| 3 | 800 | 0.20 | a |
②结合表中数据,判断该反应的△H>0(填“>”或“<”),理由是计算700°C和800°C的平衡常数K1<K2,所以△H>0.
③实验3达到平衡时,NO的转化率为67%.(保留2位有效数字)
④根据实验2数据,假设反应在t1时刻达到平衡,若t2时刻保持温度不变,将容器体积压缩至原来一半,请在图中作出整个过程中CO2的体积分数(CO2)随时间变化的曲线.
1.蛇文石矿可以看作是由MgO、Fe2O3、Al2O3、SiO2组成.由蛇文石制取碱式碳酸镁的实验步骤如下:

(1)蛇文石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是Fe3+、Al3+.
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见下表)
Ca(OH)2不能过量,若Ca(OH)2过量会导致Al(OH)3溶解、生成Mg(OH)2沉淀.
(3)从沉淀混合物A中提取红色氧化物做颜料,先向沉淀物A中加入NaOH或Ca(OH)2(填物质的化学式),然后过滤、洗涤、灼烧(依次填写实验操作名称).
(4)物质循环使用可节约能源.上述实验中,可以循环使用的物质是碳酸钙或二氧化碳(填写物质的名称).
(5)设计一个实验,确定产品a MgCO3•b Mg(OH)2•cH2O中的a、b、c的值.将32.8g产品完全分解后,产生13.2g CO2和16.0g MgO.由此可知,产品的化学式中a:b:c=3:1:3.(填最简整数比)

(1)蛇文石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是Fe3+、Al3+.
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见下表)
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.3 | 9.6 |
(3)从沉淀混合物A中提取红色氧化物做颜料,先向沉淀物A中加入NaOH或Ca(OH)2(填物质的化学式),然后过滤、洗涤、灼烧(依次填写实验操作名称).
(4)物质循环使用可节约能源.上述实验中,可以循环使用的物质是碳酸钙或二氧化碳(填写物质的名称).
(5)设计一个实验,确定产品a MgCO3•b Mg(OH)2•cH2O中的a、b、c的值.将32.8g产品完全分解后,产生13.2g CO2和16.0g MgO.由此可知,产品的化学式中a:b:c=3:1:3.(填最简整数比)
5.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
(1)如图1是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1;
已知:N2 (g)+2NO2 (g)?4NO(g)△H=+292.3kJ•mol-1,
则反应:2NO(g)+2CO(g)?N2(g)+2CO2(g) 的△H=-760.3kJ•mol-1;
(2)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5molO2发生反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如下表:
①写出该反应的平衡常数表达式:K=$\frac{{c}^{2}({N}_{2}{O}_{5})}{{c}^{4}(N{O}_{2}).c({O}_{2})}$,已知:K300℃>K350℃,则该反应是放热反应(填“放热”或“吸热”);
②反应达到平衡后,NO2的转化率为49.6%,若要增大NO2的转化率,可采取的措施有AD
A.降低温度 B.充入氦气,使体系压强增大
C.再充入NO2 D.再充入4mol NO2和1mol O2
③图2中表示N2O5的浓度的变化曲线是C,用O2表示从0~500s内该反应的平均速率v=0.00151mol•L-1•s-1.

(1)如图1是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1;
已知:N2 (g)+2NO2 (g)?4NO(g)△H=+292.3kJ•mol-1,
则反应:2NO(g)+2CO(g)?N2(g)+2CO2(g) 的△H=-760.3kJ•mol-1;
(2)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5molO2发生反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如下表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
②反应达到平衡后,NO2的转化率为49.6%,若要增大NO2的转化率,可采取的措施有AD
A.降低温度 B.充入氦气,使体系压强增大
C.再充入NO2 D.再充入4mol NO2和1mol O2
③图2中表示N2O5的浓度的变化曲线是C,用O2表示从0~500s内该反应的平均速率v=0.00151mol•L-1•s-1.
