题目内容
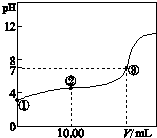 常温下,将0.1000mol L-1 NaOH溶液滴入20.00mL 0.1000mol L-1的一元酸HA溶液中,测得混合溶液的pH变化曲线如图所示.
常温下,将0.1000mol L-1 NaOH溶液滴入20.00mL 0.1000mol L-1的一元酸HA溶液中,测得混合溶液的pH变化曲线如图所示.(1)HA与NaOH溶液反应的离子方程式是
HA+OH-=A-+H2O
HA+OH-=A-+H2O
.(2)图中②点所示溶液中,下列粒子的浓度关系正确的是
ab
ab
(填序号).a.2c(Na+)=c(HA)+c(A-)
b.c(Na+)+c(H+)=c(A-)+c(OH-)
c.c(Na+)>c(A-)>c(H+)>c(OH-)
(3)图中③点所示滴入的NaOH溶液的体积V
<
<
20.00mL(填“>”、“<”或“=”).分析:(1)由图象可知0.1000mol L-1的一元酸HA溶液pH约为4,可证明HA为弱酸;
(2)图中②点酸过量,溶液呈酸性,结合物料守恒和电荷守恒解答该题;
(3)由于HA为弱酸,③点时溶液呈中性,加入NaOH体积应小于20.00mL.
(2)图中②点酸过量,溶液呈酸性,结合物料守恒和电荷守恒解答该题;
(3)由于HA为弱酸,③点时溶液呈中性,加入NaOH体积应小于20.00mL.
解答:解:(1)由图象可知0.1000mol L-1的一元酸HA溶液pH约为4,可证明HA为弱酸,则发生反应的离子方程式为HA+OH-=A-+H2O,
故答案为:HA+OH-=A-+H2O;
(2)a.②点时加入NaOH物质的量为酸的
,由物料守恒可知2c(Na+)=c(HA)+c(A-),故a正确;
b.根据电荷守恒可知c(Na+)+c(H+)=c(A-)+c(OH-),故b正确;
c..②点时加入热NaOH物质的量为酸的
,应存在c(A-)>c(Na+),故c错误,
故答案为:ab;
(3)由于HA为弱酸,③点时溶液呈中性,加入NaOH体积应小于20.00mL,故答案为:<.
故答案为:HA+OH-=A-+H2O;
(2)a.②点时加入NaOH物质的量为酸的
| 1 |
| 2 |
b.根据电荷守恒可知c(Na+)+c(H+)=c(A-)+c(OH-),故b正确;
c..②点时加入热NaOH物质的量为酸的
| 1 |
| 2 |
故答案为:ab;
(3)由于HA为弱酸,③点时溶液呈中性,加入NaOH体积应小于20.00mL,故答案为:<.
点评:本题考查酸碱混合的定性判断和计算,题目难度不大,注意根据图象判断HA为弱酸为解答该题的关键.

练习册系列答案
相关题目
下列有关离子的物质的量浓度说法正确的是( )
| A、100℃时,pH=11的Na2SiO3溶液,c(OH-)=1.0×10-3mol?L-1 | B、常温下将醋酸钠、盐酸两溶液混合后溶液呈中性,则混合溶液中:c(Na+)=c(Cl-) | C、常温下,将0.05mol?L-1硫酸加水稀释后,溶液中所有离子的浓度均减少 | D、物质的量浓度相等的①(NH4)2CO3溶液 ②(NH4)2SO4溶液 ③NH4Cl溶液中,水的电离程度:①>②>③ |