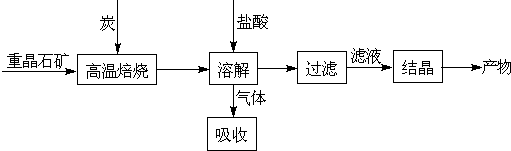
题目内容
某研究小组在实验室中以铜粉(含铁粉5%以上)为原料制取胆矾(CuSO4?5H2O)并检测其纯度.本题限选试剂:3mol?L-1 H2SO4、浓硝酸、3%H2O2、0.2mol?L-1 NaOH、20% KSCN.有关物质溶解度如下表(单位:g/100gH2O).
(1)在答题卡上补充完成制取胆矾的实验方案.
(2)完成步骤1后,检验铜粉中的铁是否除净的实验操作是 .
(3)若胆矾中若含有少量Cu(NO3)2?3H2O,测定其中CuSO4?5H2O的含量,实验步骤如下:称量胆矾样品的质量为m1,加水溶解,滴加足量BaCl2溶液,充分反应后过滤,将滤渣烘干、冷却,称得其质量为m2.样品中CuSO4?5H2O的质量分数为 (列出算式.化学式量:CuSO4-160;CuSO4?5H2O-250;Cu(NO3)2?3H2O-242;BaSO4-233)
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| CuSO4 | 14.3 | 20.7 | 28.5 | 40.0 | 55.0 | 75.4 |
| Cu(NO3)2 | 81.8 | 124.8 | 163.1 | 181.8 | 207.8 | 247.3 |
| 实验步骤 | 预期现象 |
| 步骤1:除铁.将铜粉置于烧杯中, |
|
| 步骤2:溶解.将步骤1得到的铜粉置于烧杯中, |
|
| 步骤3:结晶.将步骤2所得溶液蒸发浓缩至液面有晶膜出现,冷却至室温,过滤得粗产品. | / |
(3)若胆矾中若含有少量Cu(NO3)2?3H2O,测定其中CuSO4?5H2O的含量,实验步骤如下:称量胆矾样品的质量为m1,加水溶解,滴加足量BaCl2溶液,充分反应后过滤,将滤渣烘干、冷却,称得其质量为m2.样品中CuSO4?5H2O的质量分数为
分析:(1)由粗铜制取胆矾,应先除去铜中的杂质铁,根据铁铜的性质,选用3 mol?L-1 H2SO4,铁与硫酸反应生成硫酸亚铁和氢气,而铜不反应,反应完毕通过过滤、洗涤得到纯铜;铜和稀硫酸不反应,所以还需加入硝酸把铜氧化,铜把硝酸还原为氮的氧化物;
(2)检验铁的存在,根据所给试剂,用KSCN,而硫氰化钾遇铁离子显红色,所以应先用硫酸溶解铜粉,使其中的铁溶解,再滴加少量3%H2O2溶液把亚铁离子氧化为铁离子,再滴加几滴20%KSCN溶液看溶液是否变红来检验铁的存在;
(3)硫酸铜与氯化钡反应生成硫酸钡沉淀,而硝酸铜与氯化钡不反应,故可根据沉淀的量计算出硫酸铜晶体的质量,进而求得硫酸铜晶体的质量分数.
(2)检验铁的存在,根据所给试剂,用KSCN,而硫氰化钾遇铁离子显红色,所以应先用硫酸溶解铜粉,使其中的铁溶解,再滴加少量3%H2O2溶液把亚铁离子氧化为铁离子,再滴加几滴20%KSCN溶液看溶液是否变红来检验铁的存在;
(3)硫酸铜与氯化钡反应生成硫酸钡沉淀,而硝酸铜与氯化钡不反应,故可根据沉淀的量计算出硫酸铜晶体的质量,进而求得硫酸铜晶体的质量分数.
解答:解:(1)由粗铜制取胆矾,应先除去铜中的杂质铁,根据铁铜的性质,选用3 mol?L-1 H2SO4,铁与硫酸反应生成硫酸亚铁和氢气,而铜不反应,所以反应现象为有无色气泡产生,溶液由无色变成浅绿色.反应完毕通过过滤、洗涤得到纯铜;铜和稀硫酸不反应,所以还需加入硝酸把铜氧化为铜离子,铜把硝酸还原为氮的氧化物,所以看到的现象应为:有红棕色气体产生,溶液由无色变成蓝色.
故答案为:
(2)检验铁的存在,根据所给试剂,用KSCN,而硫氰化钾遇铁离子显红色,所以应先用硫酸溶解铜粉,使其中的铁溶解,再滴加少量3%H2O2溶液把亚铁离子氧化为铁离子,再滴加几滴20%KSCN溶液看溶液是否变红来检验铁的存在,若变红,说明铜中铁没有除净,若不变色,证明除净,
故答案为:取少量铜粉于试管中,加入少量3 mol?L-1 H2SO4溶液,充分振荡后取上层溶液于另一试管中,滴加少量3%H2O2溶液,再滴加几滴20%KSCN溶液;
(3)硫酸铜与氯化钡反应生成硫酸钡沉淀,而硝酸铜与氯化钡不反应,故m2为硫酸钡的质量.故可根据沉淀的量计算出硫酸铜晶体的质量,进而求得硫酸铜晶体的质量分数.
CuSO4+BaCl2═BaSO4↓+CuCl2
1mol 233
n( CuSO4) m2
n( CuSO4)=
mol,
n(CuSO4?5H2O=n( CuSO4)=
mol,
样品中CuSO4?5H2O的质量分数为:
×100%=
×100%=
×100%,
故答案为:
×100%.
故答案为:
| 实验步骤 | 预期现象 |
| 步骤1:加入足量3 mol?L-1 H2SO4,充分反应后过滤,充分洗涤滤渣. | 有无色气泡产生,溶液由无色变成浅绿色. |
| 步骤2:加入适量3 mol?L-1 H2SO4,再缓慢、分批地加入浓HNO3,边加边搅拌直至铜粉完全溶解. | 有红棕色气体产生,溶液由无色变成蓝色. |
故答案为:取少量铜粉于试管中,加入少量3 mol?L-1 H2SO4溶液,充分振荡后取上层溶液于另一试管中,滴加少量3%H2O2溶液,再滴加几滴20%KSCN溶液;
(3)硫酸铜与氯化钡反应生成硫酸钡沉淀,而硝酸铜与氯化钡不反应,故m2为硫酸钡的质量.故可根据沉淀的量计算出硫酸铜晶体的质量,进而求得硫酸铜晶体的质量分数.
CuSO4+BaCl2═BaSO4↓+CuCl2
1mol 233
n( CuSO4) m2
n( CuSO4)=
| m2 |
| 233 |
n(CuSO4?5H2O=n( CuSO4)=
| m2 |
| 233 |
样品中CuSO4?5H2O的质量分数为:
| m(CuSO4?5H2O) |
| m1 |
| ||
| m1 |
| 250m2 |
| 233m1 |
故答案为:
| 250m2 |
| 233m1 |
点评:本题综合考查了物质制备实验方案的设计、离子的检验及纯度的计算,题目较难.此类题一般思路为从实验目的出发,结合题目给提供的试剂,设计正确的实验方案,按题目要求作答.

练习册系列答案
相关题目
 (2007?淄博三模)铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸.某化学研究小组在实验室中按下列步骤模拟该生产过程.填写下列空白:
(2007?淄博三模)铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸.某化学研究小组在实验室中按下列步骤模拟该生产过程.填写下列空白: 对金属表面进行处理,形成一层致密的氧化物保护膜,是非常有效的一种金属防腐技术.
对金属表面进行处理,形成一层致密的氧化物保护膜,是非常有效的一种金属防腐技术.