��Ŀ����
��16�֣���ҵ�ϳɰ����Ʊ�����һ��������������������£�
��1����ҵ����ʱ����ȡ������һ����ӦΪ��CO+H2O(g)CO2+H2��t��ʱ����1L�ܱ������г���0.2molCO��0.3molˮ��������Ӧ����ƽ�����ϵ��c(H2)=0.12mol��L-1�����¶��´˷�Ӧ��ƽ�ⳣ��K=_____�������������
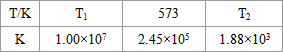
��2���ϳ����з�����ӦN2(g)+3H2(g)2NH3(g) ��H<0���±�Ϊ��ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�����ɴ˿���֪������T1____300�棨�>������<����=������
| T/�� | T1 | 300 | T2 |
| K | 1.00��107 | 2.45��105 | 1.88��103 |
��3��N2��H2���������������´�145��Ϳ�ʼ��Ӧ����ͬ�¶���NH3������ͼ��ʾ���¶ȸ���900��ʱ��NH3�����½���ԭ�� ��
��4������������ͼ�У�����¯�з�����Ӧ�Ļ�ѧ����ʽΪ
__________ _��
��5�����᳧��β��ֱ���ŷŽ���Ⱦ������Ŀǰ��ѧ��̽������ȼ�������еļ���Ƚ����������ﻹԭΪ������ˮ����Ӧ����Ϊ��
CH4(g)+4NO2(g)��4NO(g)+CO2(g)+2H2O(g) ��H= ��574kJ��mol��1
CH4(g)+4NO(g)��2N2(g)+CO2(g)+2H2O(g) ��H= ��1160kJ��mol��1
�����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ��________________________ ��
��6�������ڴ�����ȼ�գ�����һ�ֵ��ʺ�ˮ����д���÷�Ӧ�Ļ�ѧ����ʽ____________________����ѧ�����ô�ԭ������Ƴɰ���-����ȼ�ϵ�أ���ͨ�백���ĵ缫��__________����������������������������£��õ缫������Ӧ�ĵ缫��ӦʽΪ_______________________��
��1��1 ��2����
��3���¶ȸ���900��ʱ��ƽ�������ƶ���
��4��
��5��CH4(g)+2NO2(g)��CO2(g)��2H2O(g)+N2(g) ��H����867kJ/mol
��6��4NH3+3O2 ��ȼ 2N2+6H2O�������� 2NH3 �� 6e- +6OH- = N2 +6H2O
����:��1��CO + H2O(g) CO2+H2
C0 0.2 0.3 0 0
��C 0.12 0.12 0.12 0.12
C��ƽ�⣩0.08 0.18 0.12 0.12
K=��0.12��0.12��/(0.08��0.18)=1
(2)������ȣ������£�ƽ�����ƣ�Kֵ��С�����£�Kֵ��������T1��300�棻
��5��(��+��)/2���ã�CH4(g)+2NO2(g)��CO2(g)��2H2O(g)+N2(g) ��H����867kJ/mol
��6������4NH3+3O2 ��ȼ 2N2+6H2O�У�Ԫ�ػ��ϼ۵ı仯��NԪ�صĻ��ϼ��ɰ����е�-3�ۣ���Ӧ��ΪN2�е�0�ۣ�ʧ���ӣ���������ʧ���ӵķ�Ӧ��������ΪO2�õ��ӣ�
���������£�������ӦΪ��O2+2H2O+4e-=== 4OH- ,������ӦΪ=�ܷ�Ӧ-������Ӧ������2NH3 �� 6e- + 6OH- =N2 +6H2O

 �ǻ�С��ϰϵ�д�
�ǻ�С��ϰϵ�д�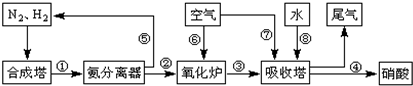
��1����ҵ����ʱ����ȡ������һ����ӦΪ��CO��g��+H2O��g��?CO2��g��+H2��g����t��ʱ����10L�ܱ������г���2mol CO��3molˮ��������Ӧ����ƽ�����ϵ��c��H2��=0.12mol?L-1������¶��´˷�Ӧ��ƽ�ⳣ��K=
��2���ϳ����з�����ӦN2��g��+3H2��g��?2NH3��g����H��0���±�Ϊ��ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�����ɴ˿���֪������T1
| T/�� | T1 | 300 | T2 |
| K | 1.00��107 | 2.45��105 | 1.88��103 |
��4���ð������������������ᣬ��β���е�NOx����Ⱦ������Ŀǰ��ѧ��̽������ȼ�������еļ���Ƚ����������ﻹԭΪ������ˮ����Ӧ����Ϊ��
CH4��g��+4NO2��g���T4NO��g��+CO2��g��+2H2O��g����H=-574kJ?mol-1
CH4��g��+4NO��g���T2N2��g��+CO2��g��+2H2O��g����H=-1160kJ?mol-1
�����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ
��5��ij�о�С����ʵ�����ԡ�Ag-ZSM-5��Ϊ��������ý�NOת��ΪN2��ת�������¶ȱ仯�������ͼ����ͼ����������ʹ��CO���¶ȳ���775�棬����NO��ת���ʽ��ͣ�����ܵ�ԭ��Ϊ
| n(NO) |
| n(CO) |
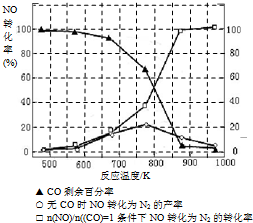

 ��3��NH3��O2�ڲ�ϵ���������´�145��Ϳ�ʼ��Ӧ��4NH3��g��+5O2��g��?4NO��g��+6H2O��g����H=-905kJ?mol-1����ͬ�¶���NO��������ͼ��ʾ���¶ȸ���900��ʱ��NO�����½���ԭ��
��3��NH3��O2�ڲ�ϵ���������´�145��Ϳ�ʼ��Ӧ��4NH3��g��+5O2��g��?4NO��g��+6H2O��g����H=-905kJ?mol-1����ͬ�¶���NO��������ͼ��ʾ���¶ȸ���900��ʱ��NO�����½���ԭ��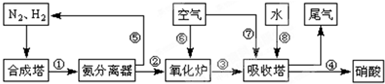
 ��3��N2��H2���������������´�145��Ϳ�ʼ��Ӧ����ͬ�¶���NH3������ͼ��ʾ���¶ȸ���900��ʱ��NH3�����½���ԭ��
��3��N2��H2���������������´�145��Ϳ�ʼ��Ӧ����ͬ�¶���NH3������ͼ��ʾ���¶ȸ���900��ʱ��NH3�����½���ԭ��


