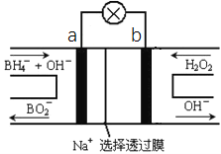
题目内容
【题目】硝酸工业尾气中氮的氧化物NO、NO2被氢氧化钠溶液吸收的主要反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O,NO2+NO+2NaOH=2NaNO2+H2O,现有aL(标准状况)NO和NO2混合气体被足量氢氧化钠溶液吸收,没有气体残余,下列说法不正确的是 ( )
A.实际参加反应的氢氧化钠的物质的量是a/22.4 mol
B.混合气体气体中NO2体积一定大于(等于)NO体积
C.溶液中NaNO3物质的量一定小于(等于)NaNO2物质的量
D.若生成的NaNO2与NaNO3的物质的量之比为3:1,则混合气体中NO与NO2的体积比为3:1
【答案】D
【解析】
A.aL(标准状况)NO和NO2混合气体的物质的量为![]() mol,被足量氢氧化钠溶液吸收,没有气体残余,根据N元素守恒可知生成NaNO2和NaNO3共
mol,被足量氢氧化钠溶液吸收,没有气体残余,根据N元素守恒可知生成NaNO2和NaNO3共![]() mol,由Na元素守恒可知消耗的NaOH的物质的量为
mol,由Na元素守恒可知消耗的NaOH的物质的量为![]() mol,故A正确;
mol,故A正确;
B.根据题目所给方程式可知只有NO2时气体可以完全被吸收,根据方程式NO2+NO+2NaOH=2NaNO2+H2O可知,当NO2的体积大于或等于NO时NO才能完全被吸收,而反应后气体没有剩余,所以混合气体中NO2体积一定大于(等于)NO体积,故B正确;
C.反应2NO2+2NaOH=NaNO2+NaNO3+H2O中生成的NaNO3和NaNO2物质的量相同,而只要有NO发生反应NO2+NO+2NaOH=2NaNO2+H2O就会使NaNO2物质的量大于NaNO3,故C正确;
D.设NaNO2与NaNO3的物质的量分别为3mol、1mol,则由2NO2+2NaOH=NaNO2+NaNO3+H2O可知,NO2的物质的量为2mol,生成NaNO2为1mol,故反应NO2+NO+2NaOH=2NaNO2+H2O中生成NaNO2为3mol-1mol=2mol,故该反应中NO2为1mol、NO为1mol,则NO2、NO的物质的量之比=(2mol+1mol):1mol=3:1,即NO与NO2的体积比为1:3,故D错误;
故答案为D。

 名校课堂系列答案
名校课堂系列答案【题目】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。吸收液吸收SO2的过程中,pH随n(Na2SO3):n(NaHSO3)变化关系如下表:
n(Na2SO3):n(NaHSO3) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
(1)由上表判断NaHSO3溶液显_____性,试解释原因______。
(2)pH=8.2的吸收液中由水电离出的c(OH-)______0.1molL-1NaOH溶液中由水电离出来的c(OH-)(填“>”、“<”或“=”)。
(3)将pH=8.2的吸收液蒸干得到固体的主要成分是______。
(4)若将等体积、等pH的NaOH溶液和Na2SO3溶液分别加水稀释m倍、n倍,稀释后两溶液pH仍相等,则m______n(填“<”、“>”或“=”)。
(5)25℃时,当吸收液为中性时,溶液中离子浓度关系正确的是______(选填字母)。
A c(Na+)=2c(SO![]() )+c(HSO
)+c(HSO![]() )
)
B c(Na+)>c(HSO![]() )>c(SO
)>c(SO![]() )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
C c(Na+)+c(H+)=c(SO![]() )+c(HSO
)+c(HSO![]() )+c(OH-)
)+c(OH-)