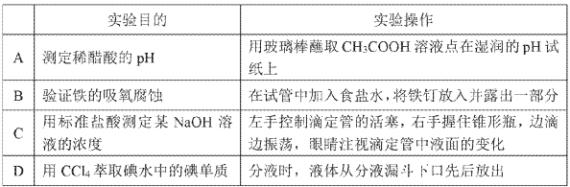
题目内容
【题目】2018年6月27日,国务院发布《打赢蓝天保卫战三年行动计划》,该计划是中国政府部署的一项污染防治行动计划,旨在持续改善空气质量,为群众留住更多蓝天。对废气的进行必要的处理,让空气更加清洁是环境科学的重要课题。
(1)已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
C (s)+O2(g)=CO2(g) △H2=-393.5kJ/mol
2C (s)+O2(g)=2CO(g) △H3=-221.0kJ/mol
若某反应的平衡常数表达式为![]() ,请写出此反应的热化学方程式_________________。
,请写出此反应的热化学方程式_________________。
(2)用如图所示的电解装置可将雾霾中的NO、SO2分别转化为NH![]() 和SO
和SO![]()
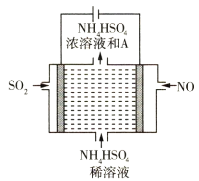
①写出物质A的化学式____________。
②NO在电极上发生的反应为 _________________。
SO2在电极上发生的反应为 __________________。
(3)工业上常用氨水吸收SO2,可生成NH4HSO3和(NH4)2SO3。
①某同学测得氨水吸收SO2所得溶液中NH4HSO3和(NH4)2SO3的物质的量之比恰好为2:1,写出该吸收过程的总反应方程式______________________________________。
②已知常温下H2S的电离常数Ka1=1.3×10-7,Ka2=7.1×10-15,将等物质的量浓度的NaHS与Na2S溶液等体积混合,所得溶液中离子浓度大小顺序为__________________。(用物质的量浓度符号由大到小排列)
【答案】2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H3=-746.5kJ/mol H2SO4 2NO+12H++10e-=2NH4++2H2O 5SO2+10H2O-10e-=5SO42-+20H+ 3SO2+4NH3·H2O=2NH4HSO3+(NH4)2SO3+H2O c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+)
N2(g)+2CO2(g) △H3=-746.5kJ/mol H2SO4 2NO+12H++10e-=2NH4++2H2O 5SO2+10H2O-10e-=5SO42-+20H+ 3SO2+4NH3·H2O=2NH4HSO3+(NH4)2SO3+H2O c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+)
【解析】
(1) 平衡常数表达式为![]() ,反应物为NO、CO,生成物为N2、CO2;根据盖斯定律,求解即可;
,反应物为NO、CO,生成物为N2、CO2;根据盖斯定律,求解即可;
(2)①SO2、NO分别变为铵根离子和硫酸根离子,则A为硫酸;
②NO在电极上失电子,变为铵根离子;SO2失电子,与水反应生成硫酸根离子和氢离子;
(3)①NH4HSO3和(NH4)2SO3的物质的量之比恰好为2:1,根据硫原子、氮原子守恒,则需要二氧化硫的系数为3,氨气为4;
②根据电离平衡常数,求解NaHS的水解平衡常数,可确定NaHS的水解程度大于电离程度,而Na2S只水解生成HS-,即可判断溶液中的离子浓度关系;
(1) 平衡常数表达式为![]() ,反应物为NO、CO,生成物为N2、CO2;①N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol;②C(s)+O2(g)=CO2(g) △H2=-393.5kJ/mol;③2C(s)+O2(g)=2CO(g) △H3=-221.0kJ/mol,根据盖斯定律,2②-①-③可得2CO(g)+ 2NO(g)= N2(g)+CO2(g) △H=-746.5kJ/mol;
,反应物为NO、CO,生成物为N2、CO2;①N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol;②C(s)+O2(g)=CO2(g) △H2=-393.5kJ/mol;③2C(s)+O2(g)=2CO(g) △H3=-221.0kJ/mol,根据盖斯定律,2②-①-③可得2CO(g)+ 2NO(g)= N2(g)+CO2(g) △H=-746.5kJ/mol;
(2)①SO2、NO分别变为铵根离子和硫酸根离子,则A为硫酸,其化学式为:H2SO4;
②NO在电极上失电子,变为铵根离子,发生的反应为2NO+12H++10e-=2NH4++2H2O;SO2失电子,与水反应生成硫酸根离子和氢离子,电极反应式为:5SO2+10H2O-10e-=5SO42-+20H+;
(3)①NH4HSO3和(NH4)2SO3的物质的量之比恰好为2:1,根据硫原子、氮原子守恒,则需要二氧化硫的系数为3,氨气为4,则方程式为:3SO2+4NH3·H2O=2NH4HSO3+(NH4)2SO3+H2O;
②HS-的水解平衡常数Kw/ Ka1=![]() ,S2-的一级水解常数(一级水解远远大于二级水解)为Kw/ Ka2=
,S2-的一级水解常数(一级水解远远大于二级水解)为Kw/ Ka2=![]() ,显然HS-的水解程度大于其电离程度,但是小于S2-的水解程度,而S2-只水解,且水解程度大于HS-的水解程度和电离程度,则溶液中的离子浓度为c(Na+)>c(HS-)>c(S2-);水解溶液呈碱性,且为少量水解,则c(S2-)>c(OH-)>c(H+),答案为:c(Na+)>c(HS-)>c(S2-)>c(OH/span>-)>c(H+)。
,显然HS-的水解程度大于其电离程度,但是小于S2-的水解程度,而S2-只水解,且水解程度大于HS-的水解程度和电离程度,则溶液中的离子浓度为c(Na+)>c(HS-)>c(S2-);水解溶液呈碱性,且为少量水解,则c(S2-)>c(OH-)>c(H+),答案为:c(Na+)>c(HS-)>c(S2-)>c(OH/span>-)>c(H+)。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】已知常温下,3种物质的电离平衡常数如下表:
物质 | HCOOH | CH3COOH | NH3·H2O |
电离平衡常数K | 1.77×104 | 1.75×105 | 1.76×105 |
下列说法不正确的是
A.等物质的量浓度时,溶液pH:HCOONa<CH3COONa
B.pH均为3时,溶液浓度:c(HCOOH)>c(CH3COOH)
C.HCOOH溶液与氨水混合,当溶液pH=7时,c(HCOO-)=c(NH4+)
D.等物质的量浓度等体积的CH3COOH溶液和氨水混合,溶液pH约为7