题目内容
【题目】金属及其化合物的种类很多,我们可以按照“金属单质、金属氧化物、金属氢氧化物、盐”的类别进行研究。以下是元素周期表中前18号某种金属元素对应的单质及其化合物之间的转化关系(“→”所指的转化都是一步完成)。

(1)A与水反应的离子方程式:_______________。
(2)若B为呼吸面具中的供氧剂,其供氧时每生成1molO2,反应过程中转移的电子数为____________。
(3)200℃时,11.6gCO2和H2O的混合物气体与足量的B反应,反应后固体增加了3.6g,则原混合物的平均相对分子质量为__________。
(4)写出一种“C→D”转化的离子方程式:_____________。
(5)某同学将一小块A单质露置于空气中,观察到下列现象:
![]() ,则下列说法正确的是
,则下列说法正确的是
A.①发生了氧化还原反应
B.①变灰暗色是因为生成了过氧化钠
C.③是碳酸钠吸收空气中的水蒸气形成了溶液
D.④只发生物理变化
【答案】
(1)2Na+2H2O=2Na++OH-+H2↑
(2)2NA或2×6.02×1023(写“2mol”不得分)
(3)23.2;(4)OH-+H+=H2O;(5)A
【解析】
试题分析:金属单质可以形成氧化物,也可以直接生成氢氧化物碱、金属氧化物可以形成碱、金属氢氧化物一步形成盐,A为活泼金属,前18号元素中只有Na符合。
(1)A为钠,与水反应的离子方程式为:2Na+2H2O=2Na++OH-+H2↑;故答案为:2Na+2H2O=2Na++OH-+H2↑;
(2)若B为呼吸面具中的供氧剂,其供氧时主要反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2↑,过氧化钠既是氧化剂又是还原剂,每生成1molO2,反应过程中转移的电子数为2NA,故答案为:2NA;
(3)200℃时水为气态,向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应方程式为:2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,固体只增加了3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8g,氧气的物质的量为:n(O2)=![]() =0.25mol,根据方程式2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑可知:n(混合气体)=2n(O2)=2×0.25mol=0.5mol,所以原混合气体的平均摩尔质量为:
=0.25mol,根据方程式2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑可知:n(混合气体)=2n(O2)=2×0.25mol=0.5mol,所以原混合气体的平均摩尔质量为:![]() =23.2g/mol,故混合气体的平均相对分子质量为23.2,故答案为:23.2;
=23.2g/mol,故混合气体的平均相对分子质量为23.2,故答案为:23.2;
(4)C→D转化的化学方程式为:NaOH+HCl=NaCl+H2O,离子方程式为OH-+H+=H2O,;故答案为:OH-+H+=H2O;
(5)Na的性质活泼,易与空气中氧气反应生成Na2O,Na2O易与水反应生成NaOH,NaOH吸收空气中的水和CO2生成Na2CO3xH2O,Na2CO3xH2O风化脱水生成Na2CO3。A、①发生氧化还原反应生成了氧化钠,故A正确;B、①发生氧化还原反应生成了氧化钠,故B错误;C、③是氢氧化钠潮解,吸收水蒸气形成氢氧化钠溶液,故C错误;D、④是二氧化碳和氢氧化钠反应生成碳酸钠固体,发生了化学反应,故D错误;故选A。

 新思维寒假作业系列答案
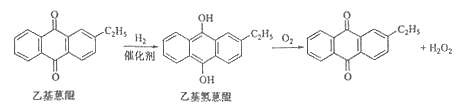
新思维寒假作业系列答案【题目】化学——选修2:化学与技术]双氧水是一种重要的氧化剂、漂白剂和消毒剂。生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:
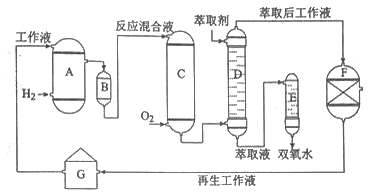
A.氢化釜 |
B.过滤器 |
C.氧化塔 |
D.萃取塔 |
E.净化塔
F.工作液再生装置
G.工作液配制装置 生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定的温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水。回答下列问题:
(1)蒽醌法制备双氧水理论上消耗的原料是 ,循环使用的原料是 ,配制工作液时采用有机溶剂而不采用水的原因是 。
(2)氢化釜A中反应的化学方程式为 ,进入氧化塔C的反应混合液中的主要溶质为 。
(3)萃取塔D中的萃取剂是,选择其作萃取剂的原因是 。
(4)工作液再生装置F中要除净残留的H2O2,原因是 。
(5)双氧水浓度可在酸性条件下用 KMnO4溶液测定,该反应的离子方程式为___________一种双氧水的质量分数为27.5%,(密度为1.10g·cm3),其浓度为 mol/L。