题目内容
【题目】常温下,将体积为V1的 0.1000mol·L-1HCl 溶液逐滴加入到体积为V2的0.1000mol·L-1Na2CO3溶液中,溶液中H2CO3、HCO3-、CO32-所占的物质的量分数(α)随pH的变化曲线如图。下列说法不正确的是
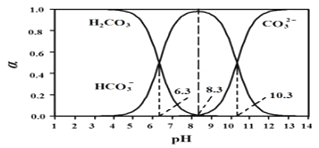
A. 在pH=10.3时,溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)+c(Cl-)
B. 在pH=8.3时,溶液中:0.1000>c(HCO3-)+c(CO32-)+c(H2CO3)
C. 在pH=6.3时,溶液中,c(Na+)>c(Cl-)>c(HCO3-)>c(H+)>c(OH-)
D. V1:V2=1:2时,c(OH-)>c(HCO3-)>c(CO32-)>c(H+)
【答案】D
【解析】试题分析:A.任何溶液中均存在电荷守恒,则在pH=10.3时,溶液中存在c(Na+) + c(H+) = c(HCO3-) + 2 c(CO32-) + c(OH -) + c(Cl-),A项正确;B.由图可知,在pH=8.3时,该溶液为NaHCO3和NaCl的混合溶液,根据物料守恒可得c(HCO3-) + c(CO32-) + c(H2CO3)=0.1000÷V<0.1000,B项正确;C.在pH=6.3时,溶液中存在NaHCO3、NaCl和碳酸,该溶液显酸性,则c(H+)>c(OH-),根据化学反应:Na2CO3+HCl="NaCl+" NaHCO3、NaHCO3+HCl=NaCl+H2CO3,所以离子浓度大小关系为 c(Na+)> c(Cl-) > c(HCO3-) >c(H+)>c(OH-),C项正确;D.V1: V2=1:2时,混合后的溶液是等物质的量浓度的Na2CO3、NaHCO3、NaCl的混合溶液,Na2CO3和NaHCO3是强碱弱酸盐,水解导致溶液显碱性,CO32-的水解程度大于HCO3-的水解程度,则溶液中c(HCO3-) > c(CO32-),由于水解程度是微弱的,所以c(HCO3-) > c(CO32-) >c(OH-)>c(H+),D项错误;答案选D.

