题目内容
【题目】砷(As)与氮、磷同一主族,可以形成As4、As2S3、As2O5、H3AsO3、H3AsO4等物质,有着广泛的用途。回答下列问题:
(1)As原子最外层电子的电子云伸展方向有___种。黄砷(As4)与白磷(P4)的结构类似,以下关于黄砷与白磷的比较叙述正确的是___(填编号)。
A.黄砷的熔点高于白磷 B.黄砷中共价键键能大于白磷
C.黄砷分子极性大于白磷 D.分子中共价键键角均为109°28′
(2)As元素的非金属性比N弱,用原子结构的知识说明理由。___。
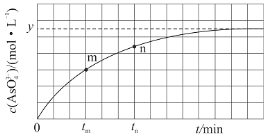
(3)298K时,将20mL3xmol/LNa3AsO3、20mL3xmol/LI2和20mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq)![]() AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
①若平衡时,pH=14,该反应的平衡常数为___。
②当反应达到平衡时,下列选项正确的是__(填标号)。
a.溶液的pH不再变化 b.v(I-)=2v(AsO33-)
c.![]() 不再变化 d.c(I-)=ymol/L
不再变化 d.c(I-)=ymol/L
③tm时,v正__v逆(填“大于”“小于”或“等于”)。
④tm时,v逆__tn时v逆(填“大于”“小于”或“等于”),理由是__。
【答案】4 A As电子层数比N多,原子半径大,质子对核外电子的吸引力弱,非金属性弱 ![]() (mol·L-1)-1 ac 大于 小于 tm时生成物浓度较低
(mol·L-1)-1 ac 大于 小于 tm时生成物浓度较低
【解析】
As和P位于相同主族,原子半径As>P,由同主族元素从上到下非金属性逐渐减弱可知非金属性P>As,形成的晶体都为分子晶体,相对分子质量越大,分子间作用力越强,以此分析解答(1)和(2);
(3)①首先计算反应前,混合溶液中反应物的浓度,根据图像,反应达到平衡时,c(AsO43-)为ymol/L,再根据反应的方程式计算平衡时各物质的浓度,最后计算平衡常数;②a.溶液pH不变时,则c(OH-)也保持不变;b.同一个化学反应,速率之比等于化学计量数之比;c.![]() 不再变化,可说明各物质的浓度不再变化;d.c (AsO43-)=y molL-1时为平衡状态,据此分析判断;③反应从正反应开始进行,tm时反应未达到平衡状态;④tm时比tn时AsO43-浓度更小。
不再变化,可说明各物质的浓度不再变化;d.c (AsO43-)=y molL-1时为平衡状态,据此分析判断;③反应从正反应开始进行,tm时反应未达到平衡状态;④tm时比tn时AsO43-浓度更小。
(1)As为33号元素,原子最外层电子的排布为4s24p3,其中4p有3种电子云伸展方向,因此电子云伸展方向共有4种;A.黄砷(As4)与白磷(P4)形成的晶体都为分子晶体,相对分子质量越大,分子间作用力越强,则熔点越高,黄砷的熔点高于白磷,故A正确;B.原子半径As>P,键长越大,键能越小,黄砷中共价键键能小于白磷,故B错误;C.黄砷(As4)与白磷(P4)都为非极性分子,分子极性相同,故C错误;D.黄砷(As4)与白磷(P4)都是正四面体结构,分子中共价键键角均为60°,故D错误;故选A,故答案为:4;A;
(2)As电子层数比N多,原子半径大,质子对核外电子的吸引力弱,非金属性弱,因此As元素的非金属性比N弱,故答案为:As电子层数比N多,原子半径大,质子对核外电子的吸引力弱,非金属性弱;
(3)①反应前,三种溶液混合后,Na3AsO3的浓度为3xmol/L×![]() =xmol/L,同理I2的浓度为xmol/L,根据图像,反应达到平衡时,c(AsO43-)为ymol/L,则反应生成的c(I-)=2ymol/L,消耗的AsO33-、I2的浓度均为ymol/L,平衡时c(AsO33-)=(x-y)mol/L,c(I2)=(x-y)mol/L,pH=14,溶液中c(OH-)=1mol/L,则K=
=xmol/L,同理I2的浓度为xmol/L,根据图像,反应达到平衡时,c(AsO43-)为ymol/L,则反应生成的c(I-)=2ymol/L,消耗的AsO33-、I2的浓度均为ymol/L,平衡时c(AsO33-)=(x-y)mol/L,c(I2)=(x-y)mol/L,pH=14,溶液中c(OH-)=1mol/L,则K=![]() =
=![]() (mol·L-1)-1,故答案为:
(mol·L-1)-1,故答案为:![]() (mol·L-1)-1;
(mol·L-1)-1;
②a.溶液pH不变时,则c(OH-)也保持不变,反应达到平衡状态,故a正确;b.同一个化学反应,速率之比等于化学计量数之比,无论是否达到平衡,都存在v(I-)=2v(AsO33-),故b错误;c.![]() 不再变化,可说明各物质的浓度不再变化,反应达到平衡状态,故c正确;d.由图可知,当c (AsO43-)=y molL-1时,浓度不再发生变化,则达到平衡状态,由方程式可知此时c(I-)=2y molL-1,所以c(I-)=y molL-1时没有达到平衡状态,故d错误;故答案为:ac;
不再变化,可说明各物质的浓度不再变化,反应达到平衡状态,故c正确;d.由图可知,当c (AsO43-)=y molL-1时,浓度不再发生变化,则达到平衡状态,由方程式可知此时c(I-)=2y molL-1,所以c(I-)=y molL-1时没有达到平衡状态,故d错误;故答案为:ac;
③反应从正反应开始进行,tm时反应未达到平衡状态,反应继续正向进行,则v正 大于 v逆,故答案为:大于;
④tm时比tn时AsO43-浓度更小,反应速率更慢,则逆反应速率更小,tm时v逆 小于tn时v逆,故答案为:小于;tm时生成物浓度较低。

 阅读快车系列答案
阅读快车系列答案