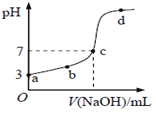
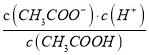题目内容
【题目】A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大。元素A是原子半径最小的元素;B元素基态原子的核外电子分占四个原子轨道;D元素原子的已成对电子总数是未成对电子总数的3倍;E与D处于同一主族;F位于ds区,且原子的最外层只有2个电子。
(1)F2+离子的电子排布式是_______________。
(2)B、C、D三种元素的电负性由大到小的顺序为___________________________
(3)B、C元素的某些氢化物的分子中均含有18个电子, B、C的这些氢化物的沸点相差较大的主要原因是________________________________________________。
(4)D、E可形成ED32-,则该离子的立体构型为____________;A、B、D可形成A2B2D4分子,1mol该物质能与2molNaHCO3反应,则1 mol该分子中含有π键的数目为________。
(5)如图表示F与E形成的化合物晶胞(黑球是F、白球是E),该化合物的化学式为________;该晶胞边长为540.0 pm,该晶体密度为____________g·cm-3

【答案】1s22s22p63s23p63d10{或[Ar]3d10} N>O>C 氮的氢化物(N2H4)分子间存在氢键 三角锥形 2NA ZnS 4.1
【解析】
A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大;元素A是原子半径最小的元素,则A是H元素;B元素基态原子的核外电子分占四个原子轨道,则B为C元素;D元素原子的已成对电子总数是未成对电子总数的3倍则D是O元素,C元素原子序数大于B而小于D,则C是N元素;E与D处于同一主族,则E是S元素;F位于ds区,且原子的最外层只有1个电子,则F为Zn元素。
(1)根据分析,F为Zn元素,Zn2+离子的电子排布式是1s22s22p63s23p63d10,简写为[Ar]3d10;
(2)同一周期从左到右电负性依次增强,所以电负性N>O>C;
(3)C、N元素氢化物中含有18个电子的分别是C2H6和N2H4,由于N2H4分子间存在氢键,而C2H6分子间只有范德华力,所以N2H4的沸点比C2H6要高得多;
(4)SO32-中的S为sp3杂化,故SO32-的空间构型为三角锥形;1molH2C2O4能与2molNaHCO3反应,说明1个H2C2O4中含有2个羧基,键线式为:![]() ,每个分子中有2个π键,故1 mol该分子中含有2
,每个分子中有2个π键,故1 mol该分子中含有2![]() 个π键;
个π键;
(5)根据图像,Zn有四个在体内,故每个晶胞Zn个数为4,S在顶点和面心,故每个晶胞Zn个数为![]() ,故化学式为ZnS;晶胞密度:
,故化学式为ZnS;晶胞密度:
![]() ;
;

 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案