题目内容
向三份0.1mol/L醋酸钠溶液中分别加入少量硝酸铵、亚硫酸钠、氯化铁固体(忽略溶液体积变化),则CH3COO-浓度的变化依次是( )
| A.增大、减小、减小 | B.增大、减小、增大 |
| C.减小、增大、增大 | D.减小、增大、减小 |
醋酸钠是强碱弱酸盐其水溶液呈碱性,硝酸铵是强酸弱碱盐其水溶液呈酸性,所以向醋酸钠溶液中加硝酸铵会促进醋酸根离子水解,导致醋酸根离子浓度减小;
亚硫酸钠是强碱弱酸盐其水溶液呈碱性,所以向醋酸钠溶液中加亚硫酸钠会抑制醋酸根离子的水解,导致醋酸根离子浓度增大;
氯化铁是强酸弱碱盐其水溶液呈酸性,所以向醋酸钠溶液中加氯化铁会促进醋酸根离子水解,导致醋酸根离子浓度减小,
故选D.
亚硫酸钠是强碱弱酸盐其水溶液呈碱性,所以向醋酸钠溶液中加亚硫酸钠会抑制醋酸根离子的水解,导致醋酸根离子浓度增大;
氯化铁是强酸弱碱盐其水溶液呈酸性,所以向醋酸钠溶液中加氯化铁会促进醋酸根离子水解,导致醋酸根离子浓度减小,
故选D.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
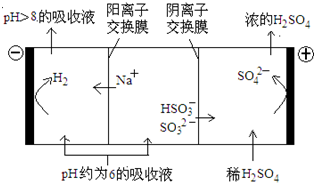
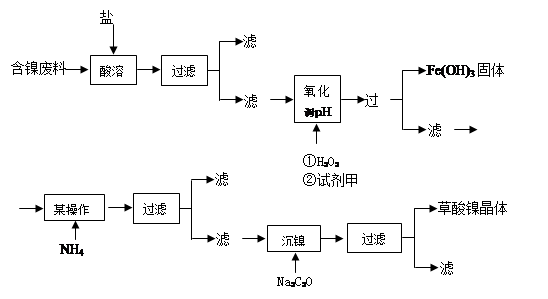
 LaNi5+6Ni(OH)2。该电池放电时,负极反应是 。
LaNi5+6Ni(OH)2。该电池放电时,负极反应是 。