题目内容
【题目】碱式碳酸铜可用于生产木材防腐剂等。工业上可用微蚀刻废液(含有一定量Cu2+、H+、SO42-、H2O2和微量Fe3+)制备高纯度碱式碳酸铜,其制备过程如下:
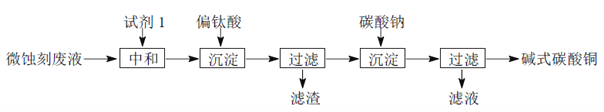
(1)试剂1最好选用________________。
a.Fe2O3 b.CaCO3 C.CuO
(2)加入Na2CO3沉淀前须除去Fe3+,否则Fe2(SO4)3会与Na2CO3反应,产生一种气体,同时生成NaFe3(OH)6(SO4)2沉淀,影响产品质量,写出该反应的化学方程式______________________。
(3)加入Na2CO3沉淀时,反应液pH对产品中SO42-的含量以及反应液中Cu2+沉淀效率的影响如下图所示,第二次沉淀时溶液pH最好控制在___________________________。

(4)所制得的碱式碳酸铜的组成可表示为:xCuCO3·yCu(OH)2·zH2O,要测定其组成,甲同学设计的实验方案中需要如下五个步骤:①称取12.0克的样品;②高温分解;③测出生成CO2的质量为2.2克;④测出生成水蒸气的质量为1.8克;⑤称量生成CuO的质量为8.0克。而乙同学认为除步骤②外,实验只需测定四个量中的部分数据即可,则合理的组合为______________(填序号,写一组即可)。根据你的选择,计算出碱式碳酸铜的组成,写出计算过程。____________________________。
【答案】 c 6Na2CO3 + 3 Fe2(SO4)3 + 6H2O = 2 NaFe3(OH)6(SO4)2 + 6CO2 +5 Na2SO4 8.5或填8.5左右的值 写四个数据中任意三个组合都正确 ( 1分) 样品中含:
n(CuCO3) = 0.05 mol
n(Cu(OH)2) = 0.05 mol
n(H2O) = 0.05 mol
样品的组成为:CuCO3Cu(OH)2H2O
【解析】试题分析:(1)目的是制备高纯度碱式碳酸铜,所以试剂1最好加入含有铜元素的物质;(2)Fe2(SO4)3会与Na2CO3发生双水解反应,产生CO2气体,同时生成NaFe3(OH)6(SO4)2沉淀,根据元素守恒写反应的化学方程式;(3) 目的是制备高纯度碱式碳酸铜,所以溶液残留铜元素越低越好;(4)根据元素守恒,n(CO2)= n(CuCO3);n(Cu(OH)2) = n(CuO)- n(CuCO3);n(H2O) =1.8g÷18g/mol-n(Cu(OH)2)。
解析:(1)目的是制备高纯度碱式碳酸铜,加入CuO不引入杂质,故C正确;(2)Fe2(SO4)3会与Na2CO3发生双水解反应,产生CO2气体,同时生成NaFe3(OH)6(SO4)2沉淀,根据元素守恒,反应的化学方程式为6Na2CO3 + 3 Fe2(SO4)3 + 6H2O = 2 NaFe3(OH)6(SO4)2 + 6CO2 +5 Na2SO4 ;(3) 目的是制备高纯度碱式碳酸铜,溶液残留铜元素越低越好,所以pH最好控制在8.5;(4)实验只需测定四个量中的CO2、CuO、H2O,根据元素守恒,n(CO2)= n(CuCO3)=2.2g÷44g/mol=0.05 mol;n(Cu(OH)2) = n(CuO)- n(CuCO3)=8.0 g÷44g/mol-0.05 mol=0.05 mol;n(H2O) =1.8g÷18g/mol-n(Cu(OH)2)=0.1 mol-0.05 mol=0.05 mol, 样品的组成为:CuCO3Cu(OH)2H2O。

 名校课堂系列答案
名校课堂系列答案【题目】为提纯下列物质(括号内为杂质),选用的除杂试剂或分离方法不正确的( )
物质 | 试剂 | 分离方法 | |
A | 乙烷(乙烯) | 溴水 | 洗气 |
B | 苯甲酸(可溶性杂质) | 水 | 重结晶 |
C | 乙醇(水) | 生石灰 | 蒸馏 |
D | 溴苯(Br2) | CCl4 | 萃取分液 |
A. AB. BC. CD. D