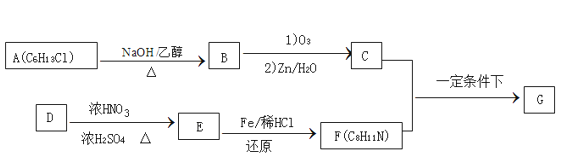
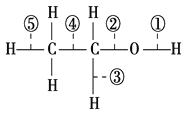
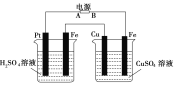
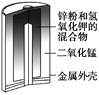
��Ŀ����
����Ŀ�����仯�����ڲ������졢�л��ϳɵȷ�����;�dz��㷺���ش��������⣺
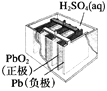
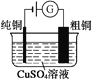
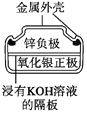
(1)VB2��һ�ֵ����մɲ��ϣ���̬��ԭ�ӵļ۵����Ų�ͼΪ___________
(2)B��C��N��O����Ԫ�ص�һ��������С�����˳��Ϊ_______________��
(3)���±�����ڹ�ҵ������Ҫ���ã��������±����ķе����±���ʾ��
±���� | BF3 | BCl3 | BBr3 | BI3 |
�е�/K | 172 | 285 | 364 | 483 |
������±����е��������ߵ�ԭ����_________________��
����BF3���ӽṹ���ͷ�ӦBF3(g)+NH4F(s)=NH4BF4(s)�ܹ�������ԭ��_________________��
���Ʊ�������ķ������£�
![]()
BCl3��LiBH4����ԭ�ӵ��ӻ������������Ϊ_________________����B3N3H6��Ϊ�ȵ�����ķ��ӵĽṹ��ʽΪ___________________��
(4)����������ľ����ṹ����ʯ�ṹ����(����ͼ)���dz�Ӳ���ϡ�

�پ�����ÿ����ԭ����Χ��������ҵȾ������ԭ����_____����
�ڽṹ��ѧ�ϳ���ԭ�����������ʾ�����ڲ���ԭ�ӵ����λ�ã�����������ľ����У� Bԭ�ӵ���������ֱ��У�B(0��0��0)��B(![]() ��0��
��0�� ![]() )��B(0��
)��B(0�� ![]() ��
�� ![]() )�ȣ��������������Bԭ������ҵȾ����Nԭ�ӵ��������Ϊ___________________��
)�ȣ��������������Bԭ������ҵȾ����Nԭ�ӵ��������Ϊ___________________��
����֪�������߳�Ϊapm����������ܶ�Ϊ____g��cm-3(��NAΪ�����ӵ�����ֵ��ֻҪ������ʽ)��
���𰸡� 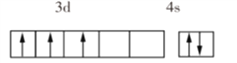 B �ṹ���ƣ���Է�������Խ���Ӽ�������Խ�е�Խ�� BF3��������ԭ���пչ�����������F-�й¶Ե��ӣ����γ���λ�� sp2��sp3
B �ṹ���ƣ���Է�������Խ���Ӽ�������Խ�е�Խ�� BF3��������ԭ���пչ�����������F-�й¶Ե��ӣ����γ���λ�� sp2��sp3  4 (1/4��1/4��1/4) 25��4/��NAa3����1030
4 (1/4��1/4��1/4) 25��4/��NAa3����1030
��������������Ҫ�������ʽṹ��
(1)��̬��ԭ�ӵļ۵����Ų�ͼΪ ��
��
(2)һ��ǽ�����Խǿ����һ������Խ�ǽ����ԣ�B<C<N<O���������ڵ�ԭ���������Ӵ��ڰ�����Ľ��ȶ�״̬��ʹ�õ��ĵ�һ�����ܴ�����������B��C��N��O����Ԫ�ص�һ��������С�����˳��ΪB<C<O<N��
(3)������±����е��������ߵ�ԭ���ǽṹ���ƣ���Է�������Խ���Ӽ�������Խ�е�Խ����
����BF3���ӽṹ���ͷ�ӦBF3(g)+NH4F(s)=NH4BF4(s)�ܹ�������ԭ��BF3��������ԭ���пչ�����������F-�й¶Ե��ӣ����γ���λ����
��BCl3��LiBH4����ԭ�ӵ��ӻ������������Ϊsp2��sp3����B3N3H6��Ϊ�ȵ�����ķ��ӵĽṹ��ʽΪ ��
��
(4)�پ�����ÿ����ԭ����Χ��������ҵȾ������ԭ����4����
�ڿɽ����½�Bԭ������ΪB(0��0��0)����ͼ��֪������������Bԭ������ҵȾ����Nԭ�ӵ��������Ϊ(1/4��1/4��1/4)��
�۾�������4��Bԭ�Ӻ�4��Nԭ�ӣ����ǵ����ԭ������֮��Ϊ100���������Ϊa3��1030cm3����������ܶ�Ϊ100/ ( NAa3)��1030g��cm-3��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�