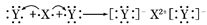题目内容
(14分)2010年在我国北方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X原子的结构示意图为  ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m=_____,该融雪剂的化学式为_______。
(2)Z、W元素名称分别为_______、_______。
(3)下列说法正确的是________。
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是________。
A.XY2的电子式:X2+[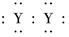 ]2-
]2-
B.WZ2的结构式:Z===W===Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2-===2Y-+Z↓
D.用电子式表示XY2的形成过程为:
(5)冰雪的化学成分是H2O,水的沸点比H2Z的沸点高,其原因是
。
(14分,每空2分)(1)20 CaCl2 (2)硫 碳 (3)B (4)B、D (5)水分子间存在氢键
解析试题分析:(1)根据元素原子的核外电子排布可知,a=2,b=8,所以质子数m=20,即该元素是Ca。又因为X的阳离子与Y的阴离子的电子层结构相同,所以Y是氯元素,则该化合物的化学式是CaCl2。
(2)元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子,因此Z是S元素,则W就是碳元素。
(3)CS2是共价化合物,A不正确;S的非金属性弱于Cl的,所以氯化氢比硫化氢稳定性强,C不正确;X的阳离子比Y的阴离子半径小,D错误,所以正确的答案选B。
(4)A不正确,氯化钙的电子式应该是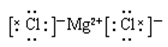 ;硫化氢是弱电解质,应该用化学式表示,C不正确,所以正确的答案选BD。
;硫化氢是弱电解质,应该用化学式表示,C不正确,所以正确的答案选BD。
(5)水分子间存在氢键,所以水的沸点比H2S的沸点高。
考点:考查原子核外电子的排布、元素周期表的结构和元素周期律的应用、电子式、结构式以及氢键的判断
点评:该题是中等难度的试题,试题综合性强,注重基础,侧重能力的培养。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案(12分)
2010年4月14日7时49分在青海省玉树地区发生7.1级地震,造成了重大的人员伤亡和财产损失。为了保证震区的卫生环境,常使用漂白液和漂白粉对环境和饮用水进行杀菌、消毒,以抑制大规模传染病爆发。
回答下列问题:
(1)漂白液的有效成分是(填化学式) ;
(2)某研究性学习小组对漂白液进行了如下实验探究:取漂白液少量,滴入3~5滴紫色石蕊试液,发现溶液先变蓝色后褪色,可以证明漂白液具有的性质 (填序号)。
| A.酸性 | B.碱性 | C.强氧化性 | D.还原性 |
。
(4)已知二氧化硫和亚硫酸盐具有较强的还原性。若将少量的SO2通入漂白粉溶液中,有同学认为发生的反应为:Ca(ClO)2+SO2+H2O=CaSO3↓+2HClO。你认为该同学的说法是否正确?
(填“正确”或“不正确”),请说明理由 。
(5)二氧化氯是世卫组织确认的A级新型高效安全的消毒剂,其安全性远高于氯气。制备方法之一是:2NaClO3 +4HCl =2ClO2↑+ Cl2↑+ 2NaCl + 2H2O,当转移0.2mol电子时,参加反应的还原剂的物质的量为 。
 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。 ]2-
]2-