题目内容
【题目】运用元素周期律研究元素及其化合物的性质具有重要意义.
部分短周期主族元素的最高价氧化物对应水化物(浓度均为0.01molL﹣1)溶液的pH和原子序数的关系如下图所示.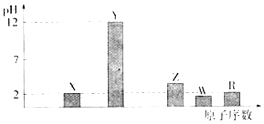
(1)元素R在周期表中的位置是 .
(2)元素Y和W形成的Y2W2型化合物中含有的化学键类型为 .
(3)X的一种氧化物XO2与水反应的化学方程式为: .
【答案】
(1)第三周期第VIIA族
(2)离子键和非极性共价键
(3)3NO2+H2O=2HNO3+NO
【解析】解:元素的金属性越强,其对应最高价氧化物的水化物碱性越强则该溶液的pH越大,元素的非金属性越强,其最高价氧化物的水化物酸性越强则该溶液的pH越小,浓度均为0.01mol.L﹣1 , 根据图象知,最高价氧化物对应的水化物,X、R都为酸且为一元强酸,Y为一元强碱,Z、W为多元酸,对应的原子序数逐渐增大,所以,X、Y、Z、W、R分别为N、Na、P、S、Cl元素.(1)R是Cl元素,主族元素原子核外电子层数与其周期数相等,最外层电子数与其族序数相等,Cl原子核外有3个电子层、最外层电子数是7,所以位于第三周期第VIIA族,所以答案是:第三周期第VIIA族;(2)元素Y和W形成的Y2W2型化合物为Na2S2 , 其电子式为: ![]() ,含有离子键、非极性共价键,所以答案是:离子键、非极性共价键;(3)X的一种氧化物是二氧化氮,二氧化氮和水反应生成硝酸和NO,反应方程式为3NO2+H2O=2HNO3+NO,
,含有离子键、非极性共价键,所以答案是:离子键、非极性共价键;(3)X的一种氧化物是二氧化氮,二氧化氮和水反应生成硝酸和NO,反应方程式为3NO2+H2O=2HNO3+NO,
所以答案是:3NO2+H2O=2HNO3+NO.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目