题目内容
【题目】将2.1g镁铝合金的碎片加入50mL盐酸中,待合金完全溶解后,生成0.1mol H2 , 得到溶液X.下列分析一定正确的是( )
A.开始时观察到金属碎片表面有极少量气泡,可能原因为该金属片表面有氧化膜
B.过程中观察到金属碎片表面有大量气泡并在液面上“翻滚”,说明该合金碎片的密度小于该盐酸溶液的密度
C.该盐酸的物质的量浓度一定为4.0 molL﹣1
D.溶液X中Mg2+与Al3+的物质的量之比一定为1:1
【答案】A
【解析】解:A、金属表面产生极少量的气体,首先与铝表面致密的氧化膜反应,然后与金属迅速反应产生大量的气泡,所以可能原因为该金属片表面有氧化膜,故A正确;
B、过程中观察到金属碎片表面有大量气泡并在液面上“翻滚”,明该合金碎片的密度大于该盐酸溶液的密度,而不是合金碎片的密度小于该盐酸溶液的密度,故B错误;
C、不知合金是否与盐酸恰好完全反应,所以无法求盐酸的物质的量,故C错误;
D、如果铝表面无氧化膜,设镁、铝的物质的量分别为xmol、ymol,则 ![]() ,解之得:
,解之得: 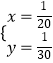 ,两者的物质的量之比不是1:1,所以不一定是1:1,故D错误;
,两者的物质的量之比不是1:1,所以不一定是1:1,故D错误;
故选A.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目