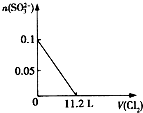
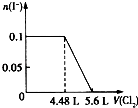
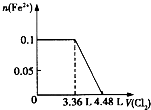
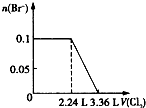
��Ŀ����
����Ŀ�����ֶ�����Ԫ��X��Y��Z��W��ԭ�����������������ϱ�����Ϣ�ش��������⣮
X | Y | Z | W | |
�ṹ | X������������Ӧ��ˮ����������̬�⻯�ﷴӦ�ɵõ�һ���� | ��ɫ��Ӧ�ʻ�ɫ | ��ͬ��������Ԫ���γɵļ������У�Z�����Ӱ뾶��С | ԭ�Ӻ��������������Ǵ�����������һ�� |
��1��д��X���ʵĵ���ʽ ��
��2��WԪ�������ڱ��е�λ��Ϊ ��
��3��Y������������Ӧˮ������Z���ʷ�Ӧ�Ļ�ѧ����ʽ ��
��4�����п���Ϊ�Ƚ�Z��Mg������ǿ���ķ�����������ţ���
a���Ƚ�����Ԫ���ڻ������л��ϼ۵ĸߵ�
b����ͬ�¶��²��Ũ����Ӧ�Ȼ���ˮ��Һ��pH
c���ڳ��������±Ƚϵ�����Ũ���ᷴӦ�ľ��ҳ̶�
d�������ֽ����Ȼ����ˮ��Һ�зֱ�μӹ�����NaOH��Һ
e���Ƚϵ��������ֽ��������ᷴӦ������Ķ��٣�
���𰸡�
��1��![]()
��2���������ڢ�A��
��3��2Al+2NaOH+2H2O=2NaAlO2+3H2��
��4��bd
���������⣺���ֶ�����Ԫ��X��Y��Z��W��ԭ��������������X������������Ӧ��ˮ����������̬�⻯�ﷴӦ�ɵõ�һ���Σ���XΪNԪ�أ�Y��ɫ��Ӧ�ʻ�ɫ����YΪNa��Z��Wԭ����������Na�����ߴ��ڵ������ڣ���ͬ��������Ԫ���γɵļ������У�Z�����Ӱ뾶��С����ZΪAl��Wԭ�Ӻ��������������Ǵ�����������һ�룬����������Ϊ4����WΪSiԪ��.
��1.��XΪNԪ�أ��䵥��Ϊ���������������к��е��������������ĵ���ʽΪ ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
��
��2.��WΪSiԪ�أ���ԭ������Ϊ14���������ڱ��е������ڢ�A�壬���Դ��ǣ��������ڢ�A�壻
��3.��Y������������Ӧˮ����ΪNaOH��Z����ΪAl����������������Һ��Ӧ����ƫ�����ƺ���������Ӧ�Ļ�ѧ����ʽΪ2Al+2NaOH+2H2O=2NaAlO2+3H2����
���Դ��ǣ�2Al+2NaOH+2H2O=2NaAlO2+3H2����
��4.��a��������ǿ���뻯�ϼ۸ߵ��أ�����ʧȥ�����������أ��������׳̶��йأ���a����
b���Ȼ���ˮ��Һ������Խǿ�������Ԫ�ص�����������Ӧˮ����ļ���Խ����������Խ������b��ȷ��
c������Al��Ũ�����з����ۻ������ܱȽϽ�����ǿ������c����
d��������þ�������������Ʒ�Ӧ�����������������������Ʒ�Ӧ��˵��������������һ�������ԣ���������þ�ļ��Ը�ǿ�����ԱȽ���Ԫ�صĽ����ԣ���d��ȷ��
e�����������ֽ��������ᷴӦ������Ķ����������ǿ���أ���e����
���Դ��ǣ�bd��