题目内容
【题目】甲同学认为Ca(OH)2与CO2能反应,而NaOH与CO2不能反应,因为实验室检验CO2用澄清石灰水而不用NaOH溶液。乙同学认为甲同学的说法不完全正确。乙同学怎么通过实验证明自己的观点呢?请你与乙同学一起在实验室完成以下实验。
【提出假设】NaOH溶液与CO2能反应。
【设计方案】(1)常用 和 反应制取CO2气体;
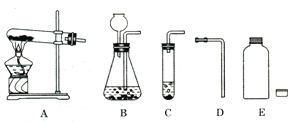
(2)请从如图所示的实验装置中选出正确的制取装置 (填字母),不选择其它发生装置的理由是 。
(3)验证假设:
实验步骤 | 实验现象 | 结论 |
第一步:向集满CO2的塑料瓶中注入少量NaOH溶液,立即旋好盖子,振荡 | NaOH溶液吸收了塑料瓶中的CO2气体 | |
第二步:取上一步中所得溶液,加入盐酸 | 有关反应的化学方程式为 |
所以,假设成立。
(4)【总结与反思】丙同学认为还应该做一个对比实验,其理由是 。
【答案】【设计方案】(1)石灰石(或大理石) 稀盐酸
(2)CDE、固液反应,不需加热且不漏气
(3)
塑料瓶变瘪 | ||
有气泡产生 | Na2CO3+2HCl=2NaCl+CO2↑+H2O |
(4)【总结与反思】二氧化碳溶解于水(与水反应)也可使气压减小,塑料瓶变瘪。(合乎题意即可)
【解析】
试题分析:(1)设计方案:①实验室制取二氧化碳的反应原理是碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,所以常用石灰石和稀盐酸反应制取CO2气体
(2)实验室制CO2气体用的是固体和液体不加热制备气体,根据反应物的状态和反应条件,应选固液在常温下的反应,即选择的装置为CDE,不选择其它发生装置的理由是固液反应,不需加热且不漏气。
(3)NaOH溶液吸收了塑料瓶中的CO2气体会导致瓶内的压强减小,所以塑料瓶变瘪;氢氧化钠会与二氧化碳反应生成碳酸钠,碳酸钠与盐酸反应会生成二氧化碳气体,所以现象是有气泡产生,反应的化学方程式为Na2CO3+2HCl=2NaCl+CO2↑+H2O;
(4)由于二氧化碳溶解于水(与水反应)也可使气压减小,塑料瓶也会变瘪,所以不能确定氢氧化钠与二氧化碳发生了化学反应。