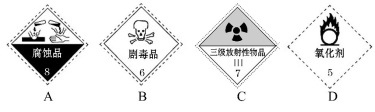
题目内容
在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中, 是氧化剂, 是还原剂, 元素被氧化, 元素被还原,若0.3mol氯气生成则若0.3mol氯气生成转移的电子数目为 。
K2Cr2O7; HCl; Cl; Cr; 0.6 NA..
【解析】
试题分析:K2Cr2O7中Cr的化合价由+6变为CrCl3中的+3,化合价降低,被还原,所以K2Cr2O7是氧化剂;HCl中一部分Cl的化合价由-1变为Cl2中的0,化合价升高,被氧化,是还原剂。若生成0.3mol氯气,转移的电子数目为0.6 NA..
考点:氧化还原反应的综合考查

练习册系列答案
相关题目