题目内容
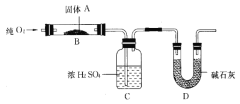
【题目】某校化学兴趣小组为研究Cl2的性质,设计如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
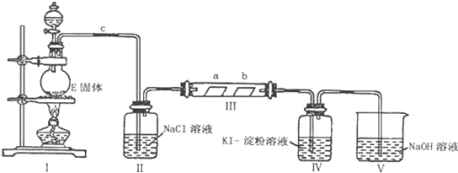
(1)实验室以二氧化锰和浓盐酸制备氯气的离子方程式是___。
(2)装置Ⅱ的作用是___。
(3)实验过程中,装置IV中的实验现象为___;发生反应的化学方程式为___。
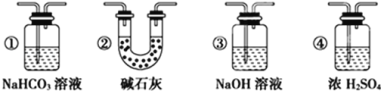
(4)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在上图装置Ⅱ与Ⅲ之间添加如图中的___装置(填序号),该装置的作用是___。
(5)装置Ⅴ的目的是防止尾气污染,写出装置Ⅴ中发生反应的离子方程式___。
【答案】MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O 除去氯气中的氯化氢气体 无色溶液变蓝色 Cl2+2KI=I2+2KCl ④ 干燥Cl2 Cl2+2OH-=Cl-+ClO-+H2O
【解析】
从装置图中看,Ⅰ为制取氯气的装置,Ⅱ为除去氯气中氯化氢的装置,Ⅲ为检验氯气漂白性的装置,Ⅳ为检验氯气氧化性的装置,Ⅴ为尾气处理装置。
(1)实验室以二氧化锰和浓盐酸制备氯气的离子方程式是MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O。答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(2)装置Ⅱ的作用是除去氯气中的氯化氢气体。
答案为:除去氯气中的氯化氢气体
(3)实验过程中,装置IV中的实验现象为无色溶液变蓝色。
答案为:无色溶液变蓝色
发生反应的化学方程式为Cl2+2KI=I2+2KCl。
答案为:Cl2+2KI=I2+2KCl
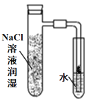
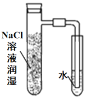
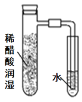
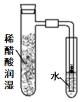
(4)因为氯气没有干燥,所以干燥的品红试纸也褪色,为了达到预期目的,应给氯气干燥,也就是在上图装置Ⅱ与Ⅲ之间添加干燥装置。
装置①中,NaHCO3会吸收Cl2,不合题意;
装置②中,碱石灰能与Cl2发生反应,不合题意;
装置③中,NaOH溶液能与Cl2发生反应,不合题意。
装置④中,浓硫酸不仅能吸收水蒸气,而且与Cl2不反应,符合题意;
所以应选择图中的④装置。答案为:④
该装置的作用是干燥Cl2。答案为:干燥Cl2
(5)装置Ⅴ的目的是防止尾气污染,发生反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O。
答案为:Cl2+2OH-=Cl-+ClO-+H2O