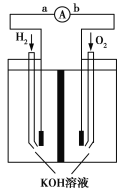
题目内容
【题目】固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是( )

A. 有O2放电的a极为电池的负极
B. 有H2放电的b极为电池的负极
C. a极对应的电极反应为O2+2H2O+4e-===4OH-
D. b极对应的电极反应为2H2-4e-+4OH-===4H2O
【答案】B
【解析】A. O2发生还原反应,所以有O2放电的a极为电池的正极,故A错误;B. H2发生氧化反应,所以有H2放电的b极为电池的负极,故B正确;C. a极对应的电极反应为O2+4e-===2O2-,故C错误;D. b极对应的电极反应为2H2-4e-+2O2-===2H2O,故D错误。故选B。

练习册系列答案
相关题目