题目内容
【题目】POCl3广泛用于染料等工业。某化学学习小组借助拉瓦锡研究空气成分的曲颈甑(装置甲)合成PC13,并采取PCl3氧化法制备POCl3。
已知:(1)PCl3的熔点为-112℃,沸点为75.5℃,遇水生成H3PO3和HCl;
(2)2PCl3+O2==2POCl3。
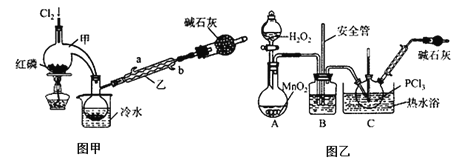
【实验Ⅰ】图甲制备PCl3
(1)实验室制备Cl2的反应方程式是_______________;
(2)碱石灰的作用除了处理尾气外还有_______________。
【实验Ⅱ】图乙制备POCl3
(3)装置B的作用除了干燥O2外,还有________________________;
(4)C中反应温度控制在60~65℃,其原因是________________________。
【实验Ⅲ】测定POCl3含量
①准确称取30.70gPOC13产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解;
②将水解液配成100.00mL溶液,取10.00mL溶液于锥形瓶中;
③加入10.00mL3.200mol/LAgNO3标准溶液,并加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖;
④以Fe3+为指示剂,用0.2000mol/LKSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00mLKSCN溶液。 已知:Ag++SCN-==AgSCN↓ Ksp(AgCl)>Ksp(AgSCN)。
(5)POC13水解的化学反应方程式为________________________。
(6)滴定终点的现象为____________,用硝基苯覆盖沉淀的目的是________________________。
(7)反应中POC13的百分含量为________________。
【答案】 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 防止空气中的水蒸气进入烧瓶,影响产品纯度 平衡压强、观察氧气的流速 温度过高,PCl3会大量挥发,导致产量降低;温度过低,反应速率会变慢 POCl3+3H2O=H3PO4+3HCl 当滴入最后一滴标准KSCN溶液时,溶液变为血红色,且半分钟不褪去 使生成的沉淀与溶液隔离,避免滴定过程中SCN-与AgCl反应 50%
MnCl2+Cl2↑+2H2O 防止空气中的水蒸气进入烧瓶,影响产品纯度 平衡压强、观察氧气的流速 温度过高,PCl3会大量挥发,导致产量降低;温度过低,反应速率会变慢 POCl3+3H2O=H3PO4+3HCl 当滴入最后一滴标准KSCN溶液时,溶液变为血红色,且半分钟不褪去 使生成的沉淀与溶液隔离,避免滴定过程中SCN-与AgCl反应 50%
【解析】考查实验方案设计与评价,(1)实验室制备氯气,常用MnO2和浓盐酸共热产生,因此化学反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;(2)根据信息(1),PCl3遇水生成H3PO2和HCl,因此碱石灰的目的不仅是尾气处理,还是防止空气中的水蒸气进入烧瓶中,造成PCl3水解;(3)装置B的作用干燥O2和、平衡压强、观察氧气的流速;(4)PCl3沸点为75.5℃,温度超过超过沸点,造成PCl3大量挥发,导致产量降低,如果温度过低,反应速率变慢;(5)按照水解定义,POCl3中P显+5价,POCl3水解的反应方程式为POCl3+3H2O=H3PO4+3HCl;(6)根据操作,用Fe3+作指示剂,滴定终点:当滴入最后一滴标准KSCN溶液时,溶液变为血红色,且半分钟不褪去;根据溶度积大小,AgSCN的溶度积小于氯化银,滴加KSCN溶液时,AgCl沉淀容易转化成AgSCN沉淀,影响实验结果,因此加入少量硝基苯的目的是使生成的沉淀与溶液隔离,避免滴定过程中AgCl与SCN-反应;(7)根据反应方程式,建立的关系式为POCl3~3HCl~3AgCl~3Ag+,参与生成AgCl的Ag+物质的量为:(10×10-3×3.2-10×10-3×0.2)mol=0.03mol,即POCl3的物质的量为0.03/3mol=0.01mol,样品中POCl3的质量为0.01×100×153.5/10g=15.35g,则纯度为15.35/30.70×100%=50%。
MnCl2+Cl2↑+2H2O;(2)根据信息(1),PCl3遇水生成H3PO2和HCl,因此碱石灰的目的不仅是尾气处理,还是防止空气中的水蒸气进入烧瓶中,造成PCl3水解;(3)装置B的作用干燥O2和、平衡压强、观察氧气的流速;(4)PCl3沸点为75.5℃,温度超过超过沸点,造成PCl3大量挥发,导致产量降低,如果温度过低,反应速率变慢;(5)按照水解定义,POCl3中P显+5价,POCl3水解的反应方程式为POCl3+3H2O=H3PO4+3HCl;(6)根据操作,用Fe3+作指示剂,滴定终点:当滴入最后一滴标准KSCN溶液时,溶液变为血红色,且半分钟不褪去;根据溶度积大小,AgSCN的溶度积小于氯化银,滴加KSCN溶液时,AgCl沉淀容易转化成AgSCN沉淀,影响实验结果,因此加入少量硝基苯的目的是使生成的沉淀与溶液隔离,避免滴定过程中AgCl与SCN-反应;(7)根据反应方程式,建立的关系式为POCl3~3HCl~3AgCl~3Ag+,参与生成AgCl的Ag+物质的量为:(10×10-3×3.2-10×10-3×0.2)mol=0.03mol,即POCl3的物质的量为0.03/3mol=0.01mol,样品中POCl3的质量为0.01×100×153.5/10g=15.35g,则纯度为15.35/30.70×100%=50%。

 名校课堂系列答案
名校课堂系列答案