题目内容
试样X由氧化亚铁和氧化铜组成,取质量相等的两份试样按图进行实验: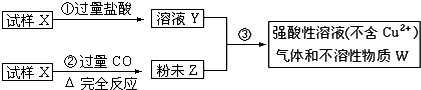
(1)请写出步聚③中发生的全部反应的离子方程式:
(2)要使试样X转变为粉末Z.除了CO外,还可以使用
A. 氢气 B.焦炭 C.氯气 D.氧气
(3)若全部的溶液Y和全部的粉未Z充分反应,生成的不溶物W的质量是m,则每份试样X中氧化铜的质量为(用m表示):
分析:(1)先判断粉末Z的成分,再根据溶液E不含铜离子判断该溶液成分,根据有气体生成,判断反应过量的物质,从而确定W的成分,写出相应的离子方程式;
(2)氢气或是碳单质可以和金属氧化物之间发生反应,将金属还原出来;
(3)根据铜的质量计算氧化铜的质量,氧化铜质量的一半为试样X中氧化铜的质量.
(2)氢气或是碳单质可以和金属氧化物之间发生反应,将金属还原出来;
(3)根据铜的质量计算氧化铜的质量,氧化铜质量的一半为试样X中氧化铜的质量.
解答:解:(1)因为CuO+CO
Cu+CO2,FeO+CO
Fe+CO2,所以固体粉末Z为Cu和Fe.铁能和铜离子发生置换反应,所以铁和铜离子发生的离子方程式为:Fe+Cu2+=Cu+Fe2+;强酸性溶液E不含铜离子,且有气体F生成,所以铁与铜离子反应铁过量,铁还和酸反应,所以铁和酸反应的离子方程式为:Fe+2H+=Fe2++H2↑,即步骤③中所发生的全部反应的离子方程式为Fe+Cu2+=Cu+Fe2+、Fe+2H+=Fe2++H2↑,故答案为:Fe+Cu2+=Cu+Fe2+、Fe+2H+=Fe2++H2↑;
(2)氧化亚铁和氧化铜都转化为固体粉末Cu和Fe,可以借助还原剂将氧化物中的金属置换出来,可以用氢气或是碳单质,故答案为:AB;
(3)不溶物W为铜,铜有两部分来源,一部分是CO还原出的铜,一部分为铁与铜离子反应置换出的铜,所以用W的一半计算试样中的氧化铜的质量;
CuO-Cu
80 64
m m
所以试样中氧化铜的质量为
m×
=
m=0.625m,
故答案为:0.625m.
| ||
| ||
(2)氧化亚铁和氧化铜都转化为固体粉末Cu和Fe,可以借助还原剂将氧化物中的金属置换出来,可以用氢气或是碳单质,故答案为:AB;
(3)不溶物W为铜,铜有两部分来源,一部分是CO还原出的铜,一部分为铁与铜离子反应置换出的铜,所以用W的一半计算试样中的氧化铜的质量;
CuO-Cu
80 64
| 5 |
| 4 |
所以试样中氧化铜的质量为
| 5 |
| 4 |
| 1 |
| 2 |
| 5 |
| 8 |
故答案为:0.625m.
点评:本题考查了铁、铜的单质及氧化物的性质,注意试样中的氧化铜的质量时,铜来自于两份试样中的氧化铜不是一份试样中的氧化铜.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目



