题目内容
【题目】我国是世界铅生产和铅消费的最大国,而铅的冶炼方法具有成本高、污染严重等缺点。
I.铅的冶炼
一种用铅矿石(主要成分为PbS)冶炼铅的改进工艺流程如下图所示。
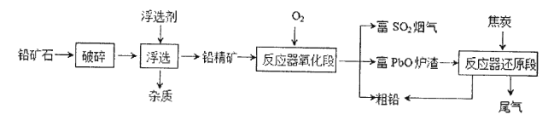
(1)浮选前将铅矿石破碎的目的是____________________
(2)反应器氧化段的主要反应有2PbS+3O2![]() 2PbO+2SO2(反应a)和PbS+2PbO
2PbO+2SO2(反应a)和PbS+2PbO![]() 3Pb+SO2(反应b),反应a中的氧化剂是_______(填化学式);反应b中氧化产物和还原产物的物质的量之比为____________。
3Pb+SO2(反应b),反应a中的氧化剂是_______(填化学式);反应b中氧化产物和还原产物的物质的量之比为____________。
(3)该工艺流程与传统方法相比优点之一就是可得到富SO2烟气,富SO2烟气可直接用于某种工业生产,请写出表示该工业生产的原理的化学方程式_________、________。
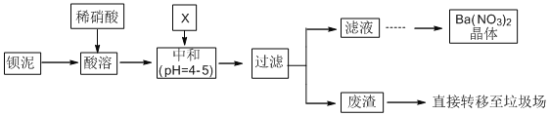
Ⅱ.含铅废水处理
化学沉淀法是除去酸性废水中Pb2+的主要方法,根据其原理不同可以分为:氢氧化物沉淀法、硫化物沉淀法、磷酸盐沉淀法、铁氧体沉淀法等。水溶液中各形态铅的百分含量x与溶液pH变化的关系如图所示。向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清。

(4)若采用氢氧化物沉淀法除溶液中的Pb2+,应将溶液的pH调至约为______。pH![]() 13时,溶液中发生的主要反应的离子方程式为________________________。
13时,溶液中发生的主要反应的离子方程式为________________________。
(5)向酸性含铅废水中加Na2S可将Pb2+转化为PbS除去,使用该方法通常先将溶液pH调至6左右,若溶液pH过低会导致_____。已知Ksp (PbS) =8.0![]() 10-28,国家规定的废水排放标准中铅含量不高于0.5mg/L,若某工厂处理过的废水中S2-浓度为2.0
10-28,国家规定的废水排放标准中铅含量不高于0.5mg/L,若某工厂处理过的废水中S2-浓度为2.0![]() 10-20mol/L,该废水中铅含量_________ (填“已经”或“尚未”)达到国家规定的排放标准。
10-20mol/L,该废水中铅含量_________ (填“已经”或“尚未”)达到国家规定的排放标准。
【答案】增大铅矿石和浮选剂的接触面积,提高浮选效率 O2 1∶3 2SO2 + O2 ![]() 2SO3 SO3+ H2O =H2SO4 10(9.5-10均可) Pb(OH)3-+ OH-= Pb(OH)42- 产生大量H2S,造成污染 已经
2SO3 SO3+ H2O =H2SO4 10(9.5-10均可) Pb(OH)3-+ OH-= Pb(OH)42- 产生大量H2S,造成污染 已经
【解析】
(1)根据浮选主要是利用物理性质对矿石进行富集分析解答;
(2)反应a:2PbS+3O2![]() 2PbO+2SO2中氧气中的O元素化合价降低;反应b:PbS+2PbO
2PbO+2SO2中氧气中的O元素化合价降低;反应b:PbS+2PbO![]() 3Pb+SO2中S元素化合价升高,Pb元素化合价降低,据此分析解答;
3Pb+SO2中S元素化合价升高,Pb元素化合价降低,据此分析解答;
(3)富SO2烟气可直接用于工业生产硫酸,据此书写工业生产硫酸的原理;
(4)根据水溶液中各形态铅的百分含量x与溶液pH变化的关系图,在pH=10左右时,主要形成氢氧化铅沉淀;pH![]() 13时,Pb(OH)3-浓度减小,Pb(OH)42-浓度增大,据此书写反应的方程式;
13时,Pb(OH)3-浓度减小,Pb(OH)42-浓度增大,据此书写反应的方程式;
(5)若溶液pH过低,表示溶液的酸性太强,Na2S会与酸反应放出H2S;根据Ksp (PbS) 计算c(Pb2+),再计算该废水中铅含量,与国家规定的排放标准相比较。
I. (1)浮选主要是利用物理性质对矿石进行富集,因此破碎的目的是为了增大铅矿石和浮选剂的接触面积,提高浮选效率,故答案为:增大铅矿石和浮选剂的接触面积,提高浮选效率;
(2)反应a:2PbS+3O2![]() 2PbO+2SO2中氧气中的O元素化合价降低,为氧化剂;反应b:PbS+2PbO
2PbO+2SO2中氧气中的O元素化合价降低,为氧化剂;反应b:PbS+2PbO![]() 3Pb+SO2中S元素化合价升高,Pb元素化合价降低,氧化产物为SO2,还原产物为Pb,氧化产物和还原产物的物质的量之比为1∶3,故答案为:O2;1∶3;
3Pb+SO2中S元素化合价升高,Pb元素化合价降低,氧化产物为SO2,还原产物为Pb,氧化产物和还原产物的物质的量之比为1∶3,故答案为:O2;1∶3;
(3)富SO2烟气可直接用于工业生产硫酸,工业生产硫酸的原理为2SO2 + O2 ![]() 2SO3;SO3+ H2O =H2SO4,故答案为:2SO2 + O2
2SO3;SO3+ H2O =H2SO4,故答案为:2SO2 + O2 ![]() 2SO3;SO3+ H2O =H2SO4;
2SO3;SO3+ H2O =H2SO4;
Ⅱ. (4)若采用氢氧化物沉淀法除溶液中的Pb2+,根据水溶液中各形态铅的百分含量x与溶液pH变化的关系图,在pH=10左右时,主要形成氢氧化铅沉淀,应将溶液的pH调至约为10;pH![]() 13时,Pb(OH)3-浓度减小,Pb(OH)42-浓度增大,Pb(OH)3-与氢氧根离子反应结合生成Pb(OH)42-,反应的离子方程式为Pb(OH)3-+ OH-= Pb(OH)42-,故答案为:10;Pb(OH)3-+ OH-= Pb(OH)42-;
13时,Pb(OH)3-浓度减小,Pb(OH)42-浓度增大,Pb(OH)3-与氢氧根离子反应结合生成Pb(OH)42-,反应的离子方程式为Pb(OH)3-+ OH-= Pb(OH)42-,故答案为:10;Pb(OH)3-+ OH-= Pb(OH)42-;
(5)向酸性含铅废水中加Na2S可将Pb2+转化为PbS除去,使用该方法通常先将溶液pH调至6左右,若溶液pH过低,溶液的酸性太强,Na2S会与酸反应放出H2S,造成污染;废水中S2-浓度为2.0![]() 10-20mol/L,根据Ksp (PbS) =8.0
10-20mol/L,根据Ksp (PbS) =8.0![]() 10-28,c(Pb2+)=
10-28,c(Pb2+)=![]() =4.0
=4.0![]() 10-8 mol/L,1L该废水中铅含量=(4.0×10-8×207×1000)mg=8.28×10-3 mg,即该废水中铅含量为8.28×10-3 mg/L<0.5mg/L,已经达到国家规定的排放标准,故答案为:产生大量H2S,造成污染;已经。
10-8 mol/L,1L该废水中铅含量=(4.0×10-8×207×1000)mg=8.28×10-3 mg,即该废水中铅含量为8.28×10-3 mg/L<0.5mg/L,已经达到国家规定的排放标准,故答案为:产生大量H2S,造成污染;已经。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案【题目】乙烯是重要的化工原料。用CO2催化加氢可制取乙烯:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH<0
C2H4(g)+4H2O(g) ΔH<0
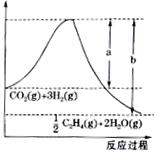
(1)若该反应体系的能量随反应过程变化关系如图所示,则该反应的ΔH=_________kJ·mol1。(用含a、b的式子表示)
(2)几种化学键的键能如表所示,实验测得上述反应的ΔH= 152 kJ·mol1,则表中的x=___________。
化学键 | C=O | H-H | C=C | C-H | O-H |
键能/(kJ·mol-1) | 803 | 436 | x | 414 | 463 |
(3)向1 L恒容密闭容器中通入1 mol CO2和n mol H2,在一定条件下发生上述反应,测得CO2的转化率α(CO2)与反应温度、投料比X[ n(H2)/n(CO2 )]的关系如图所示。
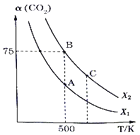
①X1_________(填“>”、“<”或“=”,下同)X2;
②平衡常数KA_______KB,KB________KC;
③若B点时X=3,则平衡常数KB=_____________(代入数据列出算式即可);
④下列措施能同时满足增大反应速率和提高CO2转化率的是(__________)
a.升高温度 b.加入催化剂 c.增大投料比X d.将产物从反应体系中分离出来
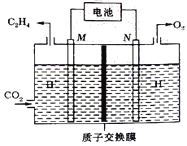
(4)以稀硫酸为电解质溶液,利用太阳能电池将CO2转化为乙烯的工作原理如图所示。则N极上的电极反应式为:_______________;该电解池中所发生的总反应的化学方程式为:__________________。