题目内容
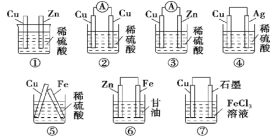
【题目】如图是金属牺牲阳极的阴极保护法的实验装置,有关说法正确的是
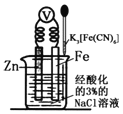
A. 若加入K3[Fe(CN)6]溶液后,Fe电极附近不会产生特征蓝色的沉淀
B. 本实验牺牲了金属Fe来保护金属Zn
C. 该装置为电解池
D. 远洋货轮上镶嵌的金属Zn长时间没有什么变化,不需要更换
【答案】A
【解析】
锌的金属性强于铁,与铁构成原电池,在酸性条件下发生析氢腐蚀,锌易失电子作负极,铁作正极,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应,据此解答。
A.铁被保护,所以溶液中不会产生亚铁离子,加入K3[Fe(CN)6]溶液后,Fe电极附近不会产生特征蓝色的沉淀,A正确;
B.锌活泼失电子作负极,铁作正极,所以牺牲了锌保护了铁,B错误;
C.该装置没有外接电源,所以是原电池而不是电解池,C错误;
D.远洋货轮船底镶嵌锌块,其中锌与铁构成原电池,锌活泼作负极失电子发生氧化反应,锌被腐蚀,为保护货轮需定期更换,D错误;
答案选A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目