题目内容
(2010?丰台区一模)下列说法或表达正确的是( )
①次氯酸的电子式为H:Cl:O:
②含有离子键的化合物都是离子化合物
③强电解质溶液的导电能力一定比弱电解质溶液强
④丁达尔效应可用于区别溶液和胶体,运、雾均能产生丁达尔效应
⑤将金属a与外加直流电源的正极相连,将负极接到废铁上,可防止金属a被腐蚀.
①次氯酸的电子式为H:Cl:O:
②含有离子键的化合物都是离子化合物
③强电解质溶液的导电能力一定比弱电解质溶液强
④丁达尔效应可用于区别溶液和胶体,运、雾均能产生丁达尔效应
⑤将金属a与外加直流电源的正极相连,将负极接到废铁上,可防止金属a被腐蚀.
分析:①次氯酸分子中氯原子呈1个共价键,氧原子呈2个共价键;未成键的孤对电子对未画出.
②由离子键形成的化合物是离子化合物.
③溶液的导电能力与离子浓度与离子的电荷有关,浓度越大、所带电荷越大,导电能力越强.
④胶体具有丁达尔效应,溶液没有丁达尔效应,云、雾都属于胶体.
⑤将金属a与外加直流电源的正极相连,金属a为电解池的阳极,被氧化,加速金属a被腐蚀.
②由离子键形成的化合物是离子化合物.
③溶液的导电能力与离子浓度与离子的电荷有关,浓度越大、所带电荷越大,导电能力越强.
④胶体具有丁达尔效应,溶液没有丁达尔效应,云、雾都属于胶体.
⑤将金属a与外加直流电源的正极相连,金属a为电解池的阳极,被氧化,加速金属a被腐蚀.
解答:解:①次氯酸分子中氯原子呈1个共价键,氧原子呈2个共价键;未成键的孤对电子对未画出,次氯酸电子式为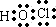 ,故①错误;
,故①错误;
②由离子键形成的化合物是离子化合物,只要含有离子键的化合物就是离子化合物,离子化合物可以含有共价键,故②正确;
③溶液的导电能力与离子浓度与离子的电荷有关,浓度越大、所带电荷越多,导电能力越强,与强弱电解质无关,强电解质溶液的导电能力不一定强,如硫酸钡是强电解质,难溶水,几乎不导电,故③错误;
④胶体具有丁达尔效应,溶液没有丁达尔效应,可以用丁达尔效应区别,云、雾都属于胶体具有丁达尔效应,故④正确;
⑤将金属a与外加直流电源的正极相连,金属a为电解池的阳极,被氧化,加速金属a被腐蚀,防止金属a被腐蚀,应连接电源的负极,故⑤错误.
所以②④正确.
故选:B.
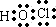 ,故①错误;
,故①错误;②由离子键形成的化合物是离子化合物,只要含有离子键的化合物就是离子化合物,离子化合物可以含有共价键,故②正确;
③溶液的导电能力与离子浓度与离子的电荷有关,浓度越大、所带电荷越多,导电能力越强,与强弱电解质无关,强电解质溶液的导电能力不一定强,如硫酸钡是强电解质,难溶水,几乎不导电,故③错误;
④胶体具有丁达尔效应,溶液没有丁达尔效应,可以用丁达尔效应区别,云、雾都属于胶体具有丁达尔效应,故④正确;
⑤将金属a与外加直流电源的正极相连,金属a为电解池的阳极,被氧化,加速金属a被腐蚀,防止金属a被腐蚀,应连接电源的负极,故⑤错误.
所以②④正确.
故选:B.
点评:题目综合性较大,涉及电子式、物质结构、电解质溶液、胶体、电解池等,难度不大,旨在考查学生对基础知识的掌握与理解.注意次氯酸的电子式书写容易受分子式书写影响,根据稳定结构书写.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
 (2010?丰台区一模)X、Y、Z、W有如图所示的转化关系,则X、Y可能是①C、CO②S、SO2③AlCl3、Al(OH)3
(2010?丰台区一模)X、Y、Z、W有如图所示的转化关系,则X、Y可能是①C、CO②S、SO2③AlCl3、Al(OH)3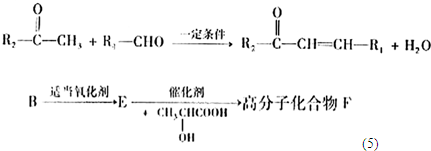
 +
+
 +H2O
+H2O
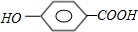 +n
+n
 +(2n-1)H2O
+(2n-1)H2O +(2n-1)H2O
+(2n-1)H2O (2010?丰台区一模)[化学与技术]工业上可以利用氟硅酸、碳酸氢铵制备冰晶石(Na3AlF6),其工艺如下:
(2010?丰台区一模)[化学与技术]工业上可以利用氟硅酸、碳酸氢铵制备冰晶石(Na3AlF6),其工艺如下:
 NH3?H2O+H+、HCO3-+H2O
NH3?H2O+H+、HCO3-+H2O