题目内容
(2010?丰台区一模)常温下,将NaHY晶体加入水中溶解,得到0.1mol/L NaHY溶液,下列叙述正确的是( )
分析:A.若NaHY溶液的pH=4,说明HY-电离程度大于HY-水解程度;
B.若NaHY的水溶液显碱性,说明HY-水解程度大于HY-电离程度;
C.根据溶液电中性原则和物料守恒的角度分析;
D.如电离程度大于水解程度,抑制水的电离,如水解程度大于电离程度,促进水的电离.
B.若NaHY的水溶液显碱性,说明HY-水解程度大于HY-电离程度;
C.根据溶液电中性原则和物料守恒的角度分析;
D.如电离程度大于水解程度,抑制水的电离,如水解程度大于电离程度,促进水的电离.
解答:解:A.若NaHY溶液的pH=4,说明HY-电离程度大于HY-水解程度,则有c(Y2-)>c(H2Y),因溶液中还存在水的电离,则c(H+)>c(Y2-),故c(Na+)>c(HY-)>c(H+)>c(Y2-)>c(H2Y),故A正确;
B.若NaHY的水溶液显碱性,说明HY-水解程度大于HY-电离程度,单水解程度一般较弱,应存在c(HY-)>c(OH-),故B错误;
C.无论溶液呈酸性,还是呈碱性,溶液中存在电荷守恒:c(H+)+c(Na+)=c(HY-)+2c(Y2-)+c(OH-),物料守恒:c(Na+)=c(HY-)+c(Y2-)+c(H2Y),二者联式可得c(H+)+c(H2Y)=c(OH-)+c(Y2-),故C错误;
D.如电离程度大于水解程度,抑制水的电离,如水解程度大于电离程度,促进水的电离,故D错误.
故选A.
B.若NaHY的水溶液显碱性,说明HY-水解程度大于HY-电离程度,单水解程度一般较弱,应存在c(HY-)>c(OH-),故B错误;
C.无论溶液呈酸性,还是呈碱性,溶液中存在电荷守恒:c(H+)+c(Na+)=c(HY-)+2c(Y2-)+c(OH-),物料守恒:c(Na+)=c(HY-)+c(Y2-)+c(H2Y),二者联式可得c(H+)+c(H2Y)=c(OH-)+c(Y2-),故C错误;
D.如电离程度大于水解程度,抑制水的电离,如水解程度大于电离程度,促进水的电离,故D错误.
故选A.
点评:本题考查离子浓度的大小比较,题目难度中等,本题易错点为C,注意从溶液的电荷守恒和物料守恒的角度分析,无论是酸性溶液还是碱性溶液,都存在c(H+)+c(H2Y)=c(OH-)+c(Y2-).

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2010?丰台区一模)X、Y、Z、W有如图所示的转化关系,则X、Y可能是①C、CO②S、SO2③AlCl3、Al(OH)3
(2010?丰台区一模)X、Y、Z、W有如图所示的转化关系,则X、Y可能是①C、CO②S、SO2③AlCl3、Al(OH)3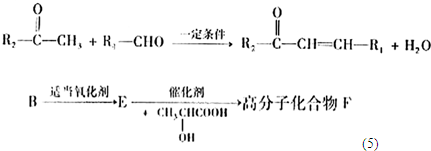
 +
+
 +H2O
+H2O
 +n
+n
 +(2n-1)H2O
+(2n-1)H2O +(2n-1)H2O
+(2n-1)H2O (2010?丰台区一模)[化学与技术]工业上可以利用氟硅酸、碳酸氢铵制备冰晶石(Na3AlF6),其工艺如下:
(2010?丰台区一模)[化学与技术]工业上可以利用氟硅酸、碳酸氢铵制备冰晶石(Na3AlF6),其工艺如下:
 NH3?H2O+H+、HCO3-+H2O
NH3?H2O+H+、HCO3-+H2O